Enfermedad de Crohn
| Enfermedad de Crohn | ||
|---|---|---|
 | ||
| Especialidad | Gastroenterología | |
| Síntomas | Dolor abdominal, diarrea (algunas veces con sangre), fiebre, pérdida de peso | |
| Complicaciones | Anemia, eflorescencia, artritis, cáncer colorrectal | |
| Inicio habitual | Entre los 20 y 30 años | |
| Duración | Crónica, con episodios intercalados de brotes y remisiones. | |
| Causas | Desconocidas; combinación de factores ambientales, inmunes y micrológicos en individuos genéticamente susceptibles | |
| Factores de riesgo | Dieta occidental, tabaco, historia familiar. | |
| Diagnóstico | Biopsias, diagnóstico por imágenes | |
| Medicación | Corticosteroides, metotrexato, terapia biológica | |
| Pronóstico | Esperanza de vida ligeramente reducida. | |
La enfermedad de Crohn es una enfermedad inflamatoria crónica con manifestaciones intermitentes que afectan principalmente al tracto gastrointestinal en toda su extensión (desde la boca hasta el ano) de causas desconocidas. Junto con la colitis ulcerosa forma parte de las llamadas enfermedades inflamatorias intestinales.
La enfermedad de Crohn produce síntomas significativos tales como dolor abdominal, diarrea, incontinencia fecal, sangrado rectal, tenesmo, pérdida de peso, anemia, y fatiga. Los síntomas extraintestinales pueden comprometer la piel, las articulaciones, la vía biliar y los ojos. Debido a la inflamación recurrente y a veces cronificada, pueden desarrollarse obstrucciones intestinales, y los enfermos están en mayor riesgo de desarrollar cáncer de colon.
Si bien se desconoce la causa de la enfermedad de Crohn, se cree que se debe a una combinación de factores ambientales, inmunitarios y microbiológicos en individuos genéticamente susceptibles. El resultado es un trastorno inflamatorio crónico en el que el sistema inmunitario ataca al tracto gastrointestinal, posiblemente enfocándose en antígenos antimicrobianos. Aunque la enfermedad de Crohn guarda una relación estrecha con la inmunidad, parece no ser de carácter autoinmunitario (ya que dicho sistema no es activado por el propio organismo). El problema inmunitario subyacente exacto no está claro; sin embargo, hallazgos recientes parecen indicar que se trata de un estado de inmunodeficiencia. Alrededor de la mitad del riesgo total de desarrollar la enfermedad está relacionado con la genética, con más de 70 genes descubiertos hasta ahora que están involucrados. Los fumadores de tabaco tienen el doble de probabilidades de desarrollar la enfermedad de Crohn que los no fumadores. El factor desencadenante es en muchos casos una gastroenteritis. El diagnóstico se basa en una serie de hallazgos incluyendo biopsias, apariencia de la pared intestinal, localización de las zonas afectadas del tracto gastrodigestivo, técnicas de imagen médicas, y descripción de los síntomas. Otras condiciones que pueden mostrar síntomas en común son el síndrome del intestino irritable y la enfermedad de Behçet.
No hay medicamentos ni procedimientos quirúrgicos que puedan curar la enfermedad de Crohn. Las opciones de tratamiento tienen la intención de reducir los síntomas, mantener la remisión y prevenir las recaídas. En los recién diagnosticados, se pueden utilizar corticosteroides durante un breve período de tiempo para mejorar rápidamente los síntomas e inducir la remisión, junto con otros medicamentos que permitan prevenir la recurrencia, como el metotrexato o las tiopurinas. También se recomienda a los pacientes dejar de fumar.
Una de cada cinco personas con la enfermedad es hospitalizada cada año, y la mitad de los enfermos necesitarán cirugía en un período de diez años desde el diagnóstico. Aunque la cirugía debe ser un último recurso, es necesaria para tratar algunos abscesos, ciertas obstrucciones intestinales, y cánceres. Es recomendable que los pacientes se realicen colonoscopias cada pocos años para controlar la evolución de la enfermedad así como para la prevención del cáncer de colon, recomendándose especialmente cuando han pasado ocho años desde el diagnóstico.
La enfermedad de Crohn afecta aproximadamente a 3,2 de cada 1000 personas en Europa y Norteamérica. Es menos común en Asia y África. Históricamente ha sido más común en el mundo desarrollado, si bien las tasas han ido en aumento desde la década de 1970 especialmente en el mundo en vías de desarrollo. El conjunto de las enfermedades intestinales inflamatorias causaron 47 400 muertes en 2015. En el mundo desarrollado no es habitual morir a causa de estas enfermedades, aunque sí pueden producir una importante merma en la calidad de vida. Se estima que los enfermos de Crohn tienen una ligera reducción en la esperanza de vida.
Tiende a comenzar en la adolescencia y en la veintena, aunque puede ocurrir a cualquier edad. Existe una correlación entre la edad de comienzo de los síntomas y la agresividad de la enfermedad, de forma que la enfermedad tiene peor pronóstico cuanto más temprana sea la aparición de la misma. Los hombres y las mujeres son afectados con la misma incidencia.
La enfermedad debe su nombre al gastroenterólogo Burrill Bernard Crohn, quien en 1932, junto con otros dos compañeros del Hospital Monte Sinaí, en Nueva York, describió una serie de pacientes con inflamación del íleon terminal del intestino delgado, el área más comúnmente afectada por la enfermedad.
Clasificación
Desde mediados de 2006, se acepta la llamada clasificación de Montreal, que fue propuesta por la Organización Mundial de Gastroenterología, y que clasifica a los pacientes en función de la edad de comienzo, localización de la enfermedad y comportamiento de esta.
En cuanto a la edad de comienzo, se distinguen los tipos A1 (menos de 16 años), A2 (de 16 a 40) y A3 (más de 40).
En cuanto a la localización, L1 (íleon y quizás zonas vecinas del ciego), L2 (colon solo) y L3 (suma de L1 y L2); además, se añade "+L4" en caso de que el paciente tenga afectada la parte alta del tubo digestivo (esófago, estómago, duodeno, yeyuno o íleon proximal).
En cuanto al comportamiento, se definen B1 (tipo inflamatorio, predominan las manifestaciones de inflamación); B2 (tipo estenosante, predominan las estenosis o estrecheces en el tubo digestivo); y B3 (tipo perforante, predominan las fístulas y fisuras). En cualquier caso, si hay afectación de la región anal, se añade "+P".
Así, una persona que comienza con la enfermedad a los 30 años, tiene afectado el colon y el esófago, y tiene un patrón con estrecheces de intestino y, además, fístulas en el ano, tiene patrón A2, L2+L4, B2+P.
Dependiendo del lugar de la inflamación se clasifica el Crohn en:
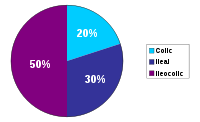
- Ileocolitis, es la forma más común, afecta la parte inferior del intestino delgado (íleon) y el intestino grueso (colon).
- Enteritis de Crohn, afecta al intestino delgado en general.
- Ileítis, que afecta al íleon o porción final del intestino delgado.
- Enfermedad de Crohn gastroduodenal, que causa inflamación en el estómago y la primera parte del intestino delgado, denominada duodeno.
- Yeyunoileítis, que ocasiona parches de inflamación desiguales en la mitad superior del intestino delgado (yeyuno).
- Colitis de Crohn (granulomatosa), que afecta al colon.
- Crohn en estado crítico estenosante, se han documentado pocos casos en el mundo y se da cuando la enfermedad no responde a ningún tratamiento, en este caso se procedería a la cirugía si el área afectada no fuese muy extensa.
Etiología
La causa de la enfermedad de Crohn es desconocida. Se han reconocido factores inmunológicos, microbiológicos, ambientales y genéticos que aumentan el riesgo de padecerla. La hipótesis más aceptada en cuanto a la importancia de estos factores señala que existe una susceptibilidad individual determinada genéticamente, lo cual incide en que frente a una desregulación autoinmunitaria frente a determinados factores ambientales, dentro de los cuales la microbiota juega una importancia relevante, la enfermedad se desarrollaría.
Factores genéticos
La historia familiar es uno de los factores de riesgo más relevantes. Contar con un familiar de primer grado con Enfermedad de Crohn incrementa 10 veces el riesgo de padecerla; por otro lado, entre un 9 a un 15 % de los pacientes con enfermedad de Crohn tienen un familiar de primer grado que la padece. En el caso de gemelos monocigotos, la probabilidad de padecer la enfermedad en forma conjunta oscila entre un 35 a 50 %.
Para la enfermedad de Crohn, se han identificado y confirmado 71 loci de susceptibilidad en 17 cromosomas.
Recientes estudios de asociación del genoma completo han demostrado que la enfermedad de Crohn está genéticamente relacionada con la enfermedad celíaca.
Factores inmunológicos
La enfermedad de Crohn se acompaña de alteraciones tanto del sistema inmunitario innato como del adaptativo. En el caso del innato, se encuentran alteradas la barrera de la capa mucosa y los niveles de péptidos antimicrobianos protectores (tales como el α-defensina) se encuentran bajo lo normal. También se ven afectadas las células dendríticas, los receptores tipo Toll, las moléculas de adhesión celular, los marcadores coestimulatorios y la secreción de citoquinas. En el caso del sistema inmunitario adaptativo, las alteraciones que se encuentran son: desequilibrio entre las células efectoras proinflamatorias tales como los Th1 y los Th17 (que producen interleucina-2, interleucina-12, interleucina-17, factor de necrosis tumoral) y las células regulatorias como los Treg y los Th3 (que producen citoquinas como la interleucina-10 y el factor de crecimiento transformante beta).
Se ha demostrado también una debilidad en la impermeabilidad entre las células epiteliales del intestino, posiblemente debido a cambios en las claudinas componente esencial para la unión estrecha intercelular, lo cual permite el acceso de carga antigénica del lumen intestinal a la lámina propia, rica en células inmunitarias.
Factores ambientales
Fumar tabaco incrementa la severidad y la velocidad de avance de la enfermedad de Crohn.
Las dietas que contienen bajas cargas antigénicas significan una regresión y alivio de las manifestaciones de la enfermedad en niños. No hay estudios categóricos en cuanto a la existencia de otras interacciones entre la dieta y la enfermedad de Crohn.
Respecto del microbioma, la disminución de firmicutes (especialmente Faecalibacterium prausnitzii) y de los bacteroides spp se asocia con la enfermedad de Crohn.
Teorías
Desde su descubrimiento hace un siglo han surgido varias teorías de la causa, incluyendo la autoinmunidad, la infección micobacteriana y la respuesta inmune errónea a los alimentos y otros materiales ingeridos. No existen pruebas sólidas para ninguna de estas teorías.
Infección por micobacterias
La infección por Mycobacterium avium paratuberculosis (MAP) ha sido propuesta como causa tanto de la enfermedad de Crohn como de la colitis ulcerosa.
Inmunodeficiencia innata
Evidencia reciente en el campo de la biología molecular y las investigaciones clínicas indican que la enfermedad de Crohn es en realidad una inmunodeficiencia primaria. La predisposición común a su padecimiento resulta de un fracaso de la respuesta inflamatoria aguda al daño tisular.
La teoría propuesta consta de tres etapas:
- Una infección gastrointestinal como desencadenante. Los individuos afectados son generalmente normales antes de desarrollar la enfermedad. Una infección gastrointestinal (por ejemplo, una gastroenteritis) desencadena la enfermedad. El culpable de la aparición de la enfermedad no es la infección en sí misma, que normalmente es superada, sino el daño intestinal que produce.
- Respuesta insuficiente de la respuesta inflamatoria aguda a las bacterias en el tejido intestinal. El agente que causó la infección desencadenante vulnerabilizó la barrera intestinal, permitiendo que la materia fecal penetre el interior de la pared intestinal. En individuos sanos, la respuesta inmune innata es capaz de limpiar la carga bacteriana y de partículas fecales que ha penetrado el tejido y el organismo finalmente vuelve a la homeostasis normal. En individuos con la enfermedad de Crohn, el sistema inmune innato es defectuoso y la eliminación de las bacterias es ineficaz y más lenta.
- Inflamación granulomatosa y respuesta del sistema inmune adaptativo. Debido a la incapacidad del sistema innato para limpiar el tejido, el sistema inmune adaptativo entra en acción: los tejidos intestinales se infiltran con un gran número de células T, que así como los macrófagos, reaccionarán produciendo citoquinas que causan inflamación local y síntomas sistémicos. La inflamación granulomatosa es característica de la enfermedad de Crohn; probablemente se deba a la presencia de nidos de material insoluble en los tejidos, que son fagocitados si son lo suficientemente pequeños, o permanecen extracelulares si son demasiado grandes. La inflamación se cronifica indefinidamente, debido a que la barrera intestinal permanece dañada debido a la inflamación, y el flujo fecal y de bacterias no se detiene.
A continuación se explica parte de la evidencia que respalda esta teoría:
- Tras una inyección subcutánea con E. Coli, los enfermos de Crohn tienen un aumento del flujo sanguíneo mucho más atenuado que la población sana, especialmente en la enfermedad colónica, y los niveles de neutrófilos en la sangre periférica, interleucina-6 y proteína C reactiva son marcadamente más elevados.
- En personas sanas, se produce la acumulación eficaz de neutrófilos en los tejidos infectados o dañados. En los enfermos de Crohn, la acumulación es defectiva y se da de forma marcadamente más lenta. El hecho de que el flujo sanguíneo y la acumulación de neutrófilos sean defectuosos en la piel, los tejidos subcutáneos y en el intestino, apunta a una anormalidad de inflamación sistémica y no entérica local.
- Se ha demostrado de forma directa que estas deficiencias de la inflamación aguda dan lugar a una eliminación fallida o retardada de las bacterias que han penetrado los tejidos. Se inyectó E. Coli marcada con Fósforo-32-radiol: mientras que en personas sanas la limpieza del tejido se dio en un promedio de 10 días, en enfermos de Crohn se demoró cuatro veces más, y en algunos casos la eliminación se prolongaba indefinidamente. Este efecto era proporcional a la cantidad de bacterias inyectadas, y solo se hacía manifiesto a partir de cierta cantidad umbral: ≥107 bacterias. Esto explica que, a pesar de que la anormalidad causante de la enfermedad de Crohn es sistémica, normalmente solo se manifiesta en el intestino porque es el único lugar del cuerpo humano donde en condiciones normales se alcanzan tales concentraciones de bacterias (colón e íleon distal).
- Ensayos clínicos recientes del factor estimulante de colonias de granulocitos y monocitos (GM-CSF) en EC, con el objetivo de estimular el sistema inmunológico innato, han demostrado un beneficio clínico y refuerzan esta teoría de la patogenia de la enfermedad.
A pesar de que la causa de la enfermedad de Crohn fuera una inmunodeficiencia, los inmunosupresores (principal forma de tratamiento de la enfermedad en la actualidad) resultarían eficaces debido a que suprimen la respuesta del sistema inmune, deteniendo el proceso inflamatorio, pero no tratando la causa real. Algunos investigadores creen que esto favorece la exacerbación y la periodización de la enfermedad.
Los avances en la edición de genes con la tecnología CRISPR-Cas hacen que el tratamiento correctivo de la enfermedad de Crohn sea una posibilidad real en un futuro relativamente cercano. La médula ósea podría ser extraída, editada y reinfundida en un paciente condicionado, de una manera muy similar a la empleada en la terapia génica para inmunodeficiencias primarias.
Patogenia
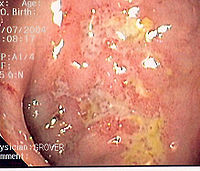
La enfermedad de Crohn presenta inflamación transmural en cualquier parte del tracto gastrointestinal, siendo los lugares más comunes el íleo distal, el colon y el perineo. Habitualmente el compromiso es multifocal. La mucosa comprometida se encuentra entre mucosa sana, lo que es un signo característico de la enfermedad. Las lesiones son profundas y tienden a la fistulización y a la cicatrización estenosante.
El análisis histológico muestra inflamación trasmural, con infiltración de linfocitos y células plasmáticas, destrucción de las criptas y la presencia de granulomas no caseosos.
Signos y síntomas
Gastrointestinales
Los síntomas de la enfermedad de Crohn son heterogéneos, pero la gran mayoría de los casos se presenta con diarrea de más de 6 semanas de duración, dolor abdominal y pérdida de peso, en personas relativamente jóvenes. Un 40 a un 50 % de los pacientes con enfermedad de Crohn presentan sangre o mucus en la materia fecal. También se presentan con frecuencia síntomas sistémicos como malestar general, anorexia o fiebre. El compromiso osteoarticular es la manifestación extraintestinal más frecuente, especialmente si existe compromiso del colon, presentándose dolor en articulaciones periféricas o en el esqueleto axial. La complicación más frecuente al momento del diagnóstico es la presencia de fístulas perianales, en un 10 % de los casos.
La enfermedad de Crohn se caracteriza por períodos de actividad (brotes) e inactividad (remisión). Estos períodos varían según los pacientes, en algunos la remisión dura años; sin embargo en otros se pueden producir brotes continuos. Las fases de remisión se caracterizan por la ausencia de síntomas, mientras en las fases de actividad se presentan mayoritariamente dolores abdominales, diarrea, vómitos, obstrucciones, fiebre, pérdida de apetito y pérdida de peso.
Los pacientes pueden tener síntomas muy variables. Unos pocos no sufren casi molestias, otros pocos tienen molestias graves y continuas, y la mayoría se encuentra entre uno y otro extremo, con síntomas que aparecen y desaparecen, mejorando generalmente con el tratamiento.
Dependiendo de dónde esté localizada la enfermedad, los síntomas pueden variar. Las personas con afectación del intestino delgado, la más común, tienen sobre todo diarrea, dolor abdominal y lo que se llama síntomas generales: debilidad, pérdida de peso, falta de apetito. En el caso de la afectación del colon, va a predominar la diarrea, a veces con sangre.
También el tipo de enfermedad determina los síntomas. Los pacientes que tienen síntomas inflamatorios suelen sufrir más dolor y diarrea, mientras que los que tienen síntomas de estenosis o estrechez, tienen menos dolor, y están en riesgo de desarrollar una obstrucción intestinal.
Es importante recordar que la enfermedad de Crohn puede afectar al ano, produciendo lesiones de tipo fístula, absceso o úlcera, con sus correspondientes molestias.
En cada paciente se pueden añadir otros síntomas, como los dependientes de la anemia (debilidad, palidez), de las manifestaciones extraintestinales (dolores articulares, lesiones en la piel), muchos otros síntomas digestivos (vómitos, por ejemplo).
También se producen algunas complicaciones como consecuencia de la inflamación intestinal como la obstrucción intestinal, fístulas entre vísceras vecinas o megacolon tóxico, incluso la muerte del paciente si la enfermedad está en estado crítico.
Sistémicos
Como muchas otras enfermedades inflamatorias crónicas, la enfermedad de Crohn puede causar una variedad de síntomas sistémicos. Entre los niños, el retraso del crecimiento es común, y a menudo es uno de los síntomas con los que son diagnosticados. Debido a que la enfermedad puede manifestarse en la época de mayor crecimiento de la pubertad, hasta el 30 % de los niños con Crohn pueden tener retraso en el crecimiento. Debido a los episodios de brotes, también pueden sufrir retrasos en el rendimiento escolar y el desarrollo sexual.
La fiebre puede presentarse como síntoma, siendo poco común las mayores a 38,5 °C (grados Celsius), a menos que exista una complicación como un absceso.
La pérdida de peso es una manifestación común que tiene causas conjuntas. Por un lado, los pacientes pueden perder el apetito a causa de los síntomas intestinales, y a menudo se sienten mejor cuando no comen. Por otro lado, la inflamación activa produce pérdidas de proteínas y otros elementos a través del intestino, y aumenta el consumo de energía del organismo. Por último, aquellos con afectación del intestino delgado pueden tener problemas de asimilación de nutrientes proporcionales a la extensión y gravedad de su inflamación.
Extraintestinales
Al día de hoy, todavía no se conocen con exactitud los mecanismos biológicos que dan lugar a la aparición de cada una de las manifestaciones extraintestinales. Aun así, se piensa que en alguna de ellas está implicado el sistema inmune, mientras que otras se producen como consecuencia de alteraciones anatómicas y metabólicas producidas por la Enfermedad de Crohn.
Osteoarticulares
Constituidas en dos grupos:
- Manifestaciones articulares: aparecen en un 20-30 % de pacientes y se subdividen en, artropatía periférica y axial. Dentro de la artropatía periférica se incluye la artritis tipo I y II. La artropatía axial es menos frecuente y se subdivide en sacroilitis aislada y la espondilitis anquilosante. La primera cursa sin síntomas, mientras que la segunda es una enfermedad que afecta a la columna vertebral, articulaciones sacroilíacas y la entésitis. Su prevalencia global en la Enfermedad de Crohn oscila entre el 4 y el 10 % de los pacientes. Los síntomas principales de la espondilitis anquilosante son el dolor lumbar de características inflamatorias, rigidez matutina y tras periodos de inactividad, y la entesitis, típica del tendón de Aquiles y de la planta del pie.
- Patología metabólica ósea: constituye un factor de riesgo para el desarrollo de osteoporosis y osteopenia, con una frecuencia que oscila entre un 2-30 % y un 40-50 % de los pacientes, respectivamente.
Existen unos síntomas de alarma que obligan a una pronta valoración médica. Entre estos se incluyen: fiebre, síndrome constitucional (cansancio y pérdida de apetito y peso), pérdida de fuerza o sensibilidad, dolor de tipo neuropático (continuo, quemante, no relacionado con el movimiento), empeoramiento progresivo de los síntomas, pérdida de control de esfínteres con desarrollo de incontinencia anal y/o urinaria.
Cutáneas
Entre un 10 y un 20 % de pacientes con Crohn las cursan. Entre las más importantes se incluyen el eritema nodoso, el pioderma gangrenoso y la estomatitis aftosa.
Oculares
Entre un 2 y un 5 % de los pacientes con Crohn la presentan. Las dos más frecuentes son la epiescleritis y la uveítis.
Orales

- Extra-orales: Tumefacción de labio, párpado y cara. También se observa queilitis angular.
- Intra-orales: Gingivitis granular, mucosa bucal/labial en forma de empedrado y tags mucosos. La manifestación más típica es de ulceraciones orales tipo Afta, pero de márgenes solevantados en forma de "cresta de ola". También se ha descrito una mayor prevalencia de periodontitis apical en sujetos afectos.
Diagnóstico
Biopsias intestinales
El estudio de muestras de biopsias intestinales es fundamental para el diagnóstico de la enfermedad de Crohn. Los hallazgos de lesiones típicas de esta enfermedad mediante la toma de muestras obtenidas durante una colonoscopia (en la que preferiblemente se acceda también al íleon) permiten confirmar el diagnóstico, pero no descartarlo. Esto se debe a que en ocasiones la afectación se encuentra únicamente en el intestino delgado, por lo que es necesario ampliar el estudio.
Analíticas sanguíneas
Los análisis sanguíneos son necesarios para diagnosticar y controlar a los pacientes con enfermedad de Crohn. El hemograma permite determinar la existencia de anemia (disminución de hemoglobina), leucocitosis (aumento de glóbulos blancos), trombocitosis (aumento de plaquetas), aumento de la velocidad de sedimentación, falta de hierro o de vitamina B12, descenso de la albúmina y a veces alteraciones en las pruebas del hígado. Adicionalmente, ante fase activa de la enfermedad, a nivel sanguíneo van a aumentar los llamados marcadores de inflamación, de los cuales el más importante y usado es la proteína C reactiva y la alfaglicoproteína ácida u orosomucoide
Otros análisis en relación con el diagnóstico de la enfermedad de Crohn, van encaminados a asegurar que no se trata de enfermedades parecidas (por ejemplo infecciones,) ya que algunas de las infecciones intestinales cursan de una manera similar a como lo hace las enfermedades inflamatorias intestinales. Los ensayos más importantes son el cultivo de heces (coprocultivo), el examen de parásitos en heces y la detección de toxinas de microbios en la deposición, entre otros. No es extraño que en aquellos pacientes con Crohn, exista una sobreinfección por lo que en caso de brote que no ceda al tratamiento, se descarte la existencia de algún patógeno que simule un brote y que impida la recuperación del paciente.
Hay unos análisis de inmunología que pueden servir en casos dudosos. Para ello se analiza la presencia de los marcadores llamados ANCAs a(anticuerpos que suelen ser positivos en la colitis ulcerosa), y los llamados ASCAs (en la enfermedad de Crohn). No se usan mucho al no estar disponibles en todos los centros.
Diagnóstico diferencial
Las principales enfermedades que se pueden confundir con la enfermedad de Crohn incluyen la colitis ulcerosa, la enfermedad celíaca, la tuberculosis intestinal, la úlcera rectal solitaria, la enfermedad de Behçet, la enteropatía causada por la toma de antiinflamatorios no esteroideos y el síndrome del intestino irritable.
El síndrome del intestino irritable se excluye cuando hay cambios inflamatorios. La enfermedad celíaca no puede excluirse con una analítica de sangre ni por la ausencia de atrofia de las vellosidades del intestino delgado. La mayoría de los celíacos antes del diagnóstico presenta anticuerpos de la enfermedad celíaca negativos e inflamación intestinal leve o moderada, sin atrofia de las vellosidades.
El análisis conjunto de la expresión intestinal de diferentes galectinas permite distinguir entre pacientes con EII activa y pacientes control, EII inactiva o en remisión. Además, este análisis brinda una herramienta eficiente para determinar el grado de inflamación de la mucosa colónica y distinguirla de otras patologías inflamatorias intestinales agudas y crónicas, lo que podría constituir un marcador de la historia de la patología en el paciente.
Tratamiento
La enfermedad a día de hoy es incurable, pero sí es controlable. En los episodios de remisión, la mayoría de los pacientes puede hacer una vida normal. El fin del tratamiento es inducir la remisión cuando la enfermedad se encuentra activa, y una vez se alcanza la remisión, evitar nuevas recaídas.
Junto a la medicación, los cambios en el estilo de vida son importantes, y pueden ayudar a reducir los síntomas de la enfermedad, así como mejorar el pronóstico. Se recomienda el cese del tabaco en los fumadores, una alimentación sana que evite los alimentos que desencadenen síntomas, mantener una correcta hidratación, y la práctica regular de ejercicio físico no extenuante.
Farmacológico
Constituye la base terapéutica del tratamiento de la enfermedad. Existe una serie de fármacos que se introducen secuencialmente según lo requiera la gravedad de la enfermedad. La elección de los fármacos también depende de las características de la enfermedad tales como su localización.
- En el primer nivel de tratamiento se emplea el ácido 5-aminosalicílico, antibióticos como el metronidazol, el ciprofloxacino y esteroides de liberación tópica y localizada en el tracto digestivo, como la budesónida (liberado en el íleon). El ciprofloxacino es un antibiótico del grupo de las fluoroquinolonas, y en la actualidad no se recomienda su uso debido a los graves posibles efectos secundarios permanentes, salvo en ocasiones excepcionales donde la gravedad de la enfermedad lo requiera.
- En el segundo nivel de tratamiento, se incluyen los glucocorticoides, que debido a los importantes efectos secundarios que produce su uso prolongado, solo deben emplearse en brotes agudos, generalmente durante ocho o diez semanas. Una pequeña parte de los pacientes no responde a los corticoides (corticorefractarios), y una parte importante depende de su administración continua (corticodependientes) puesto que una suspensión o bajada de la dosis conduce a un empeoramiento o reaparición de los síntomas. Los corticoides más empleados son los siguientes: Beclometasona, Budesonida, Deflazacort, Dexametasona, Hidrocortisona, Metilprednisolona y Prednisona. Junto al uso de corticoides, para mantener el efecto a largo plazo se emplean los inmunomoduladores o inmunosupresores como la azatioprina, la 6-mercaptopurina, y el metotrexato.
- Hasta solo hace dos décadas, el tercer nivel de tratamiento pertenecía a la cirugía. En la actualidad existe un conjunto de fármacos denominados biológicos que se emplean en aquellos pacientes que muestran refractariedad ante otros tratamientos. Estas terapias consiguen detener la inflamación en una considerable porción de pacientes, a veces de manera importante. Los primeros en emplearse fueron los denominados anticuerpos anti-factor de necrosis tumoral o fármacos anti-TNF: infliximab (Remicade®), y posteriormente adalimumab (Humira®). También pertenecen a esta categoría los biosimilares de infliximab, Inflectra® y Remsima®; y los biosimilares de adalimumab, Amgevita®, Hyrimoz® e Imraldi®. Posteriormente se han aprobado otros fármacos biológicos con diferentes mecanismos de acción: ustekinumab (Stelara®) y vedolizumab (Entyvio®). Se administran de forma subcutánea o con perfusión intravenosa, dependiendo del fármaco y de si se trata de una dosis de inducción o de mantenimiento. El mecanismo de acción de los fármacos anti-TNF consiste en bloquear la actividad del TNF, que es una de las moléculas responsables del proceso inflamatorio (en concreto, es una citoquina que producen varias células del sistema inmune, en especial los macrófagos y monocitos). En cuanto al fármaco ustekinumab, este bloquea la acción de las interleucinas 12 y 23 (son parte de las proteínas reguladoras de la respuesta inmunitaria); y en cuanto al fármaco vedolizumab, este es un antagonista de los receptores de integrina (receptores de membrana celular que permiten el paso de glóbulos blancos y linfocitos al intestino, lo cual sucede en grandes proporciones cuando existe inflamación intestinal).
Además de los tratamientos mencionados, en los casos en los que la afectación del íleon impide la reabsorción de la bilis pueden emplearse resinas como la colestiramina o colestipol, que se asocian a la bilis y consiguen aliviar los síntomas derivados de su malabsorción.
En algunos casos puede hacerse uso de antidiarreicos, pero existe riesgo de contraindicaciones, y por tanto son necesarias la aprobación de su uso y la supervisión ejercidas por un doctor.
Quirúrgico
No se puede curar con cirugía, ya que la enfermedad acaba reapareciendo. La cirugía se emplea para tratar complicaciones tales como la obstrucción parcial o total del intestino, fístulas o abscesos, o si la enfermedad no responde a los fármacos. A veces requiere la construcción de una ostomía.
Tras la operación, el paciente entra en una remisión de la enfermedad que usualmente dura desde meses a años. Tras la primera resección, las estadísticas indican que es común necesitar otra resección en un plazo de cinco años. La enfermedad por lo general regresa afectando al sitio donde se extirpó el intestino enfermo y se unieron los extremos sanos, aunque también puede aparecer en otros tramos. Después de una resección, el tejido cicatricial se acumula, lo que puede causar estenosis (una estrechez en el intestino) que impide que los excrementos pasen fácilmente, pudiendo conducir una obstrucción.
Para los pacientes con una obstrucción debido a una estenosis, dos opciones de tratamiento son la estricturoplastia y la resección de esa porción del intestino. No hay significación estadística entre la estricturoplastia sola versus la estricturoplastia y la resección en casos de afectación duodenal. En estos casos, las tasas de reoperación fueron del 31 % y el 27 % respectivamente, lo que indica que la estricturoplastia es un tratamiento seguro y efectivo para personas con afectación duodenal.
El Síndrome del intestino corto es causado por la extirpación quirúrgica de parte del intestino delgado. Generalmente se desarrolla en aquellos pacientes a los que se les ha extirpado la mitad o más del intestino delgado. La diarrea es el síntoma principal, pero otros síntomas pueden incluir la pérdida de peso, calambres, hinchazón y acidez estomacal. El síndrome del intestino corto se trata con cambios en la dieta, alimentación intravenosa, suplementos vitamínicos y minerales, y medicamentos. En algunos casos de SIC, la cirugía de trasplante intestinal puede ser considerada; aunque el número de centros de trasplante que ofrecen este procedimiento es muy pequeño y viene con un alto riesgo debido a la posibilidad de infección y rechazo del intestino trasplantado.
La malabsorción del ácido biliar es otra complicación de la cirugía cuando se extirpa el íleon terminal. Esto generalmente produce diarrea acuosa excesiva, que se cree que se produce debido a la incapacidad del resto del íleon para reabsorber los ácidos biliares. Fue el primer tipo de malabsorción de ácido biliar reconocido.
Nutrición enteral
Nutrición enteral exclusiva
Consiste en la administración de la totalidad de las necesidades calóricas a través de una fórmula enteral bebible, con el objeto de controlar la inflamación, inducir la remisión y favorecer la cicatrización del intestino. El paciente puede tomar la fórmula por vía oral normal o a través de una sonda nasogástrica.
Este tratamiento se emplea especialmente en la población pediátrica como alternativa al tratamiento farmacológico por corticoides, con la intención de evitar afectar adversamente el crecimiento. En la población pediátrica y en adultos de diagnóstico reciente, su efectividad para alcanzar la remisión es de hasta un 80 %. Para alcanzar esta efectividad, el tratamiento debe seguirse de forma adecuada: se deben cubrir las necesidades calóricas completas, no se deben incluir otros alimentos en la dieta, y mantenerse por un periodo habitualmente de cuatro a ocho semanas. La efectividad es menor en aquellos pacientes con afectación perianal, enfermedad aislada en colon, y aquellos con una enfermedad de largo recorrido o casos de moderados a graves.
Desde el punto de vista médico, una de las principales desventajas del tratamiento por nutrición enteral exclusiva es la falta de adherencia del paciente, que durante un periodo de tiempo extenso debe afrontar la restricción del resto de alimentos y beber una fórmula a menudo de sabor desagradable. La otra gran desventaja es que, al igual que sucede con el tratamiento de inducción por glucocorticoides, las remisiones obtenidas a menudo no son duraderas, y los síntomas regresan cuando el paciente retoma la ingesta normal de alimento.
La práctica clínica de este tipo de tratamiento está más extendido en Japón. En Europa, Australia y Canadá, su uso es minoritario, y en Estados Unidos es residual.
Nutrición enteral parcial
Cuando la nutrición enteral se combina con otros alimentos, su efectividad para inducir la remisión disminuye drásticamente. De esta forma, mientras que la nutrición enteral exclusiva (NEE) es un tratamiento indicado para la inducción de la remisión de la enfermedad, la nutrición enteral parcial (NEP) no lo es, ya que su efectividad es mucho menor. En su lugar, la nutrición enteral parcial puede utilizarse como apoyo nutricional para evitar o resolver la desnutrición en los pacientes afectados por malabsorción severa y marcada pérdida de peso.
Modificaciones dietéticas
A pesar de que aproximadamente un 61% de las personas con enfermedad de Crohn presenta alergias alimentarias y existen evidencias que apoyan la eficacia de las dietas de eliminación en estos pacientes, en la práctica no se suelen contemplar las intervenciones dietéticas como parte del tratamiento. Asimismo, hasta la fecha el interés en la realización de estudios clínicos en este campo ha sido mínimo. No se ha demostrado que las modificaciones dietéticas consigan eliminar la inflamación intestinal, por lo que cualquier intervención dietética debe ser empleada en combinación con el tratamiento farmacológico.
Dietas que incluyen mayor cantidad de fibra, frutas y verduras se asocian con riesgo reducido de sufrir la enfermedad, mientras que dietas ricas en grasas, ácidos grasos poliinsaturados, carne y ácidos omega-6 pueden incrementar el riesgo de esta enfermedad
Alimentos problemáticos
Los pacientes con enfermedad de Crohn muestran con frecuencia sensibilización a antígenos alimentarios específicos al intestino (lo que significa que no necesariamente provocarán respuesta en pruebas de alergias cutáneas).
Los componentes alimentarios que producen reacciones adversas con mayor frecuencia en los pacientes con enfermedad de Crohn son la caseína (proteína presente en los lácteos), el gluten (proteínas presentes en el trigo, la cebada, el centeno, la avena y todas sus especies e híbridos), el trigo, el maíz, la levadura, y algunas frutas y vegetales.
En una entrevista a 71 pacientes, los alimentos que con mayor frecuencia causaban molestias fueron el maíz, los frutos secos, las bebidas gaseosas, las frutas crudas, los mariscos y los encurtidos en los pacientes con ileostomía; y los frutos secos, las frutas crudas y los tomates en los pacientes sin ileostomía. Los alimentos que con menos probabilidad causaban molestias en ambos grupos fueron el pollo, el pan blanco, el arroz, las patatas y el cordero.
Dietas utilizadas en la práctica clínica
En situación de brote, en la práctica clínica generalmente se contemplan cuatro dietas:
- Baja en residuos (también denominada «dieta baja en fibra»). Está indicada en pacientes con inflamación severa, y en casos de estenosis confirmada o sospechada a fin de disminuir el riesgo de obstrucción. La fibra que generalmente se evita es la de tipo insoluble (vegetales crucíferos, piel de frutas, nueces, semillas, frutos secos, etc.).
- Baja en grasas (también denominada «dieta de protección biliar»). Está indicada en pacientes con afectación del íleon. Cuando el íleon está comprometido, la absorción de grasas y bilis es reducida, y su ingesta favorece el aumento de la diarrea y la irritación del colon.
- De protección gástrica (coloquialmente denominada «dieta blanda»).
- Sin lactosa o sin lácteos. En brote puede aparecer una intolerancia a los lácteos. En un estudio clínico en Alemania, el 46,9 % de los pacientes con Crohn presentaba intolerancia a la leche, frente al 16,9 % de la población sana. En situación de brote, en los pacientes con Crohn dicha intolerancia incrementaba al 83,3 %. La presencia de lactasa (enzima que digiere la lactosa) puede disminuir durante los brotes, pero no parece ser la causa predominante que explique la intolerancia.
No existe una pauta unificada en cuanto a la elección o la combinación de estas dietas, sino que es función de la tolerancia individual del paciente, de la gravedad de su brote, y de la zona afectada del tracto digestivo.
Otras dietas
En investigación, las dos dietas que han demostrado más eficacia en el control de los síntomas son la dieta sin gluten y la dieta baja en FODMAP.
Otras dietas que cuentan con referencias en la literatura científica de la enfermedad de Crohn son:
- Paleolítica
- Vegetariana
- IBD-AID
- CD-TREAT
- Dieta de los carbohidratos específicos, o SCD por sus siglas en inglés (Specific Carbohydrate Diet).
- Protocolo Autoinmune, también llamado «Protocolo Autoinmune Paleo», o AIP por sus siglas en inglés (Autoimmune Protocol).
- Dieta para el síndrome intestinal y psicológico, o GASP por sus siglas en inglés (Gut and Psychology Syndrome diet).
Suplementación
Los pacientes con enfermedad de Crohn a menudo presentan numerosas deficiencias nutricionales, especialmente durante los brotes. Las más comunes se enumeran a continuación:
- Vitaminas: B12, folato, vitamina D, vitamina K, vitamina E, vitamina A, vitamina B1, vitamina B2, vitamina B3, vitamina B6, biotina, vitamina C.
- Minerales: Hierro, calcio, cinc, magnesio, selenio. Para el cobre hay resultados dispares: en estudios diferentes se ha encontrado que pacientes con Crohn tienen tanto menor como mayor concentración en suero comparado con la población sana. Es posible que, debido a que el cobre y el cinc se encuentran en homeostasis en el organismo, la menor absorción de cinc que pueden sufrir los pacientes con Crohn favorezca las mayores concentraciones de cobre en algunos pacientes. Asimismo, debe tenerse en cuenta que la ceruloplasmina, proteína transportadora de cobre en la sangre, aumenta durante los estados de inflamación, de forma que los análisis de los niveles de cobre que se realicen mediante la cuantificación de esta proteína pueden arrojar resultados engañosamente elevados.
- Macronutrientes: Proteína.
- Otros oligoelementos: La concentración de luteina, zeaxantina, alfa y beta carotenos, y alfa y beta criptoxantina es significativamente menor en el suero de los pacientes de Crohn, comparado a la población sana.
La toma de suplementos de vitaminas y minerales es de utilidad para aliviar los síntomas durante los brotes de la enfermedad y/o inducir su remisión. Particularmente, la deficiencia de vitamina D parece contribuir al desarrollo y progresión de la enfermedad de Crohn.
La descalcificación ósea se ve favorecida por diversos factores: el uso de corticoides, la expulsión del calcio asociado con la bilis en los pacientes con afectación ileal, los déficits de vitamina D y K, y la baja ingesta de calcio. No obstante, la suplementación con calcio se ha cuestionado recientemente debido a los resultados de varios estudios que la relacionan con calcificaciones arteriales y un meta-análisis que mostró que dosis de suplementos de calcio superiores a 500 mg (miligramos) por día se asociaron con un mayor riesgo de infarto de miocardio.
Terapia con oxígeno hiperbárico
La oxigenoterapia hiperbárica se utilizó en los años 90, cuando la terapia con biológicos no formaba parte del arsenal de tratamientos para la enfermedad de Crohn, bajo el supuesto de que la oxigenación tisular está alterada. En la literatura científica se reporta eficacia clínica del tratamiento con oxígeno hiperbárico en la enfermedad de Crohn perianal, incluyendo pacientes refractarios al tratamiento farmacológico.
En una revisión de dos ensayos clínicos y dos casos clínicos, se observó la remisión en 15 pacientes (68,18 %) y eventos adversos en dos (16,6 %). En comparación, con infliximab (Remicade®) la tasa de remisión es 66 %. Los autores de la revisión sugieren que «en lugar de considerarlos como dos alternativas diferentes, se deberían combinar para obtener una sinergia que aumente las tasas de respuesta, acorte la cicatrización y, sobre todo, disminuya la tasa de recurrencia».
En un metaanálisis, la tasa de respuesta al tratamiento para la enfermedad de Crohn perineal fue del 88 % (18 de 40 pacientes tuvieron una curación completa de las lesiones, y 17 de 40 una curación parcial). Los autores concluyen que «la oxigenoterapia hiperbárica es una opción de tratamiento relativamente segura y potencialmente eficaz para los pacientes con enfermedad inflamatoria intestinal».
Terapia basada en células madre alogénicas
Darvadstrocel (Alofisel®) es la primera terapia avanzada con células madre mesenquimales (CMM) aprobada en la UE para el tratamiento de fístulas perianales complejas en pacientes adultos con enfermedad de Crohn luminal no activa o ligeramente activa, cuando las fístulas han presentado una respuesta inadecuada a, como mínimo, un tratamiento convencional o biológico.
Darvadstrocel consiste en una suspensión de células madre adiposas expandidas (eASC) que presentan efectos inmunomoduladores y antiinflamatorios en los focos de inflamación. Se inyecta tanto en las aberturas internas como externas, así como dentro de las vías fístulas, para inducir la cicatrización de la fístula.
En un estudio principal, en el que participaron 212 pacientes con enfermedad de Crohn y fístulas anales complejas, Alofisel® demostró mayor eficaz que el placebo. El criterio principal de valoración de la eficacia fue la «remisión combinada», que se definió como el cierre de los orificios externos anormales, junto con la ausencia de conductos internos mayores de 2 cm (centímetros) rellenos de líquido. Se logró la remisión combinada en casi el 50 % (53 de 107) de los pacientes tratados con Alofisel, en comparación con el 34 % (36 de 105) de los tratados con placebo.
Dadas las limitadas opciones de tratamiento disponibles para tratar las fístulas perianales, darvadstrocel es una terapia prometedora, novedosa y mínimamente invasiva que representa un avance importante en las opciones terapéuticas.
Fotoféresis extracorpórea
Estudios pequeños y abiertos han mostrado resultados prometedores de la fotoféresis extracorpórea en el tratamiento de la enfermedad de Crohn dependiente de esteroides y médicamente refractaria. Las tasas de respuesta en adultos son de hasta el 50%, con hasta el 25% de remisiones. Sin embargo, aún no se han realizado ensayos aleatorios controlados por placebo apropiados.
Complementarios y alternativos
Es común que las personas con enfermedad de Crohn hagan uso de terapias complementarias y alternativas. Una encuesta realizada en 2006 en Alemania encontró que cerca de la mitad de las personas con enfermedad inflamatoria intestinal usaba alguna forma de medicina alternativa, siendo la más común la homeopatía, y un estudio en Francia encontró que cerca del 30% usaba medicina alternativa.
Homeopatía
Los preparados homeopáticos no están probados con esta o cualquier otra condición, con estudios a gran escala que muestran que no son más efectivos que el placebo.
Acupuntura
La acupuntura se utiliza para tratar la enfermedad inflamatoria intestinal en China, y su uso va en aumento en la sociedad occidental. Sin embargo, la evidencia actual es insuficiente como para realizar su recomendación oficial.
Cannabis
Algunos pacientes utilizan el cannabis para el alivio de sus síntomas. No obstante, no hay evidencias suficientes que demuestren que su uso sea efectivo ni exento de riesgos como tratamiento de la enfermedad de Crohn. Los resultados de los estudios realizados hasta la fecha son contradictorios.
Fitoterapia
Algunos productos herbáceos han demostrado eficacia en la enfermedad de Crohn, si bien los estudios son escasos y la evidencia no puede considerarse concluyente.
Artemisia absinthium, en una preparación comercial junto con pétalos de rosa y semillas de cardamomo, fue estudiada en un ensayo controlado aleatoriezado, mostrando un efecto economizador de esteroides. A diferencia del grupo de control, los pacientes del grupo activo pudieron reducir la dosis de corticoides paulatinamente hasta dejarlos por completo, la mayoría de ellos sin el regreso de los síntomas de la enfermedad. En otro ensayo controlado, se registró la capacidad de Artemisia absinthium para disminuir el nivel de factor de necrosis tumoral alfa (TNF-α), una citoquina que tiene un papel importante en la enfermedad; disminuir los síntomas de la enfermedad, mejorar la calidad de vida de los pacientes, e inducir la remisión en una parte de los pacientes en comparación a un placebo.
Tripterygium wilfordii Hook F (TwHF) es ampliamente utilizado en China, y en ensayos clínicos ha mostrado superioridad al placebo para inducir la remisión y prevenir la recurrencia tras la cirugía. En un ensayo aleatorizado, en dosis de 2 mg/kg (miligramos por kilogramo) ha mostrado superioridad frente a la mesalazina para mantener la remisión, aunque también mayor proporción de efectos secundarios. En otro ensayo controlado aleatorizado, se encontraron resultados comparables pero inferiores a la azatioprina en cuanto a la eficacia para prevenir la recurrencia endoscópica.
Un extracto de resina de Boswellia serrata ha mostrado mayor eficacia para reducir los síntomas de la enfermedad que la mesalazina, así como buena tolerabilidad, aunque la diferencia entre ambos tratamientos no pudo probarse significativa estadísticamente. Sin embargo, en otro ensayo controlado, aleatorizado y de doble ciego, confirmaron su buena tolerabilidad, pero no encontraron mayor eficacia del extracto frente al placebo.
En definitiva, los resultados obtenidos en este campo son alentadores, pero los estudios son a menudo heterogéneos y limitados. La evidencia que respalda estos productos proviene de estudios pequeños con un seguimiento corto de los pacientes, por lo que aún no se ha establecido con certeza la seguridad de los mismos ni sus efectos a largo plazo.
Investigación
Actualmente se están llevando a cabo numerosas investigaciones en el campo de la farmacogenómica, con el fin de examinar si la dotación genética de un individuo permite determinar su susceptibilidad a la enfermedad o su respuesta al tratamiento. A día de hoy, los estudios genéticos no tienen ninguna aplicabilidad práctica.
Hay muchos nuevos tratamientos en estudio para la enfermedad de Crohn. Algunas líneas de investigación son las siguientes:
Tratamientos biológicos
Los tratamientos biológicos emplean sustancias fabricadas artificialmente que imitan a otras que nuestro cuerpo posee. En la actualidad ya se emplean diversas clases de biológicos en la enfermedad de Crohn, y es una línea en la que se continúa investigando:
- El certolizumab pegol (Cimzia®) es un fragmento de Fab PEGylated de un anticuerpo monoclonal humanizado anti-TNFα que en un gran ensayo mostró mayor eficacia frente al placebo.
- Traficet-EN/CCX282/GSK'786/vercirnon es un antagonista de los receptores de quimiocinas CCR9 destinado a modular la respuesta inmunitaria. Fracasó en los ensayos clínicos de fase III, sin mostrar mejoría frente al placebo.
- ABT-874 es un anticuerpo monoclonal humano anti-IL-12 que está siendo desarrollado por Abbott Laboratories en conjunto con Cambridge Antibody Technology para el tratamiento de múltiples enfermedades autoinmunes, incluyendo la enfermedad de Crohn. Los ensayos de fase II mostraron resultados prometedores.
Tratamiento contra la Mycobacterium avium paratuberculosis
Algunos equipos médicos creen que el causante de la enfermedad de Crohn es una micobacteria llamada Mycobacterium avium paratuberculosis (MAP). Este agente produce en el ganado la paratuberculosis, cuya presentación es muy similar a la enfermedad de Crohn. Como es capaz de infectar a diversas especies, se cree que una de ellas es la humana, en la que produciría la enfermedad de Crohn. Un grupo tradicionalmente interesado en este aspecto es el del Dr. Hermon Taylor, en Londres (se pueden consultar vídeos explicativos en la red).
En un ensayo llevado a cabo en Australia, se trataron a 213 pacientes divididos en dos grupos que recibían una combinación antibiótica diseñada para atacar la MAP o placebo, y se obtuvieron resultados no concluyentes. Al cabo de 2 años no hubo diferencias en la evolución de la enfermedad entre los dos grupos. Los medicamentos empleados son conocidos: claritromicina (antibiótico de la familia de los macrólidos), y clofazimina y rifabutina (antibióticos que se emplean contra la tuberculosis clásica). No obstante, no existe aún una pauta clara y recomendable.
En resumen, no hay noticias fehacientes de tratamientos nuevos en esta línea, y antes de que se permita la comercialización, se requiere evidencia médica más sólida. Es de esperar que algunos centros puedan, entretanto, llevar a cabo programas experimentales de tratamiento.
Terapia con huevos embrionados de Trichuris suis
La enfermedad de Crohn es poco común en las partes del mundo donde la población está expuesta a gusanos parasitarios (helmintos). Algunos investigadores piensan que los estilos de vida modernos, altamente higiénicos, podrían contribuir al riesgo de desarrollo de la enfermedad de Crohn. La idea subyacente a este enfoque se ha denominado la hipótesis de la higiene. Por otro lado, los helmintos disminuyen la respuesta inmunitaria en humanos colonizados naturalmente y reducen la inflamación en la colitis experimental. Bajo este contexto, se especuló que la infección con helmintos podría ser favorable para la enfermedad de Crohn. Se realizaron ensayos utilizando huevos embrionados del parásito Trichuris suis (tricocéfalo que afecta a los porcinos) que mostraron resultados prometedores en personas con enfermedades inflamatorias intestinales. En uno de los ensayos con resultados más optimistas, el 79,3 % de los pacientes mostró respuesta al tratamiento, y el 72,4 % entró en remisión. Ensayos posteriores han encontrado resultados menos alentadores. Los ensayos TRUST-I y TRUST-II fracasaron en fase 2 y se interrumpieron. Un ensayo en 2017 no encontró ninguna dosis que mostrase un efecto clínicamente relevante sobre el placebo. Un metaanálisis en 2018 concluye que «el tratamiento con TSO estadísticamente no mostró ningún beneficio para los pacientes con enfermedad inflamatoria intestinal, por lo que sugiere a los médicos que consideren cuidadosamente su valor antes de ponerlo en práctica clínicamente. Tal vez sean necesarias investigaciones continuas con muestras de mayor tamaño debido a que los resultados anteriores carecen de fuerza».
Activación de los receptores cannabinoides
Numerosos estudios preclínicos demuestran que la activación de los receptores cannabinoides CB1 y CB2 ejerce funciones biológicas en el tracto gastrointestinal, y en animales ha mostrado un fuerte efecto antiinflamatorio. Los cannabinoides y/o la modulación del sistema endocannabinoide es un nuevo medio terapéutico para el tratamiento de numerosos trastornos gastrointestinales, incluidas las enfermedades inflamatorias intestinales como la enfermedad de Crohn. Unos pocos ensayos pequeños han analizado el cannabis medicinal, pero se necesitan más pruebas para determinar su utilidad.
Factor estimulante de colonias de granulocitos y monocitos
El factor estimulante de colonias de granulocitos y monocitos, o GM-CSF por sus siglas en inglés (Granulocyte Macrophage Colony-Stimulating Factor), ha demostrado mejorar sustancialmente la calidad de vida relacionada con la salud en estudios piloto, según las mediciones mediante cuestionario. Un ensayo reciente de fase II mostró que GM-CSF redujo significativamente la gravedad de la enfermedad de Crohn (48 % en comparación con 26 % en el grupo de placebo) y mejoró la calidad de vida (40 % en comparación con 19 % para el placebo).
Naltrexona a baja dosis
Un estudio piloto encontró que la naltrexona en dosis bajas, un medicamento muy barato, ayudaba a los pacientes con enfermedad de Crohn activa. En el estudio, el 89 % de los pacientes mostraron una respuesta a la terapia, y el 67 % lograron la remisión en cuatro semanas.
Trasplante autólogo de células madre
Se ha evaluado el trasplante autólogo de células madre hematopoyéticas en pacientes con enfermedad de Crohn grave refractaria.
Suplementación con dehidroepiandrosterona (DHEA)
La evidencia científica indica que la concentración de sulfato de dehidroepiandrosterona (DHEAS) baja en sangre es una característica de la mayoría de los pacientes con enfermedad inflamatoria intestinal (EII). Se sugiere la posible existencia de una relación funcional entre los bajos niveles de DHEAS y algunas de las características fisiopatológicas de la EII, como el impacto en la función inmune.
En un estudio piloto, se suplementó a los pacientes con deshidroepiandrosterona (DHEA) a dosis mayores a las fisiológicas. Los pacientes con enfermedad de Crohn eran refractarios al tratamiento farmacológico, pero 6 de 7 enfermos de Crohn respondieron a la suplementación con DHEA y entraron en remisión. El tratamiento se juzgó eficaz y seguro. La remisión se valoró en función a criterios sintomatológicos y clínicos, por lo que se desconoce si los pacientes alcanzaron la remisión de la actividad endoscópica.
Los suplementos de DHEA son de venta libre en Estados Unidos. En la Unión Europea requieren prescripción médica.
Véase también
- Enfermedad inflamatoria intestinal
- Colitis ulcerosa
- Colitis seudomembranosa
- Enterocolitis necrosante
Bibliografía
- Lichtenstein GR, Hanauer SB, Sandborn WJ; Practice Parameters Committee of American College of Gastroenterology. Management of Crohn's disease in adults. Am J Gastroenterol. 2009;104(2):465-483.
- Fry RD, Mahmoud N, Maron DJ, Ross HM, Rombeau J. Colon and rectum. In: Townsend CM, Beauchamp RD, Evers BM, Mattox KL, eds. Sabiston Textbook of Surgery. 18th ed. Philadelphia, Pa: Saunders Elsevier; 2007:chap 50.
- Rutgeerts P, Vermeire S, Van Assche G. Biological therapies for inflammatory bowel diseases. Gastroenterology. 2009;136(4):1182-1197.
Carlucci JG et al: Vertical Transmission of Histoplasmosis Associated With Anti-Tumor Necrosis Factor Therapy J Pediatric Infect Dis Soc. 2016 Jun; 5(2): e9–e12.
Enlaces externos
- En MedlinePlus hay más información sobre Enfermedad de Crohn
- ACCU España. Confederación de asociaciones de enfermos de Crohn y colitis ulcerosa de España.
| Control de autoridades |
|
|---|
-
 Datos: Q1472
Datos: Q1472
-
 Multimedia: Crohn's disease / Q1472
Multimedia: Crohn's disease / Q1472