
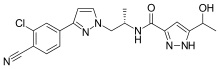
Darolutamida
| Darolutamida | ||
|---|---|---|
| ||

| ||
| Identificadores | ||
| Número CAS | 1297538-32-9 | |
| PubChem | 67171867 | |
| DrugBank | DB12941 | |
| ChemSpider | 38772320 | |
| UNII | X05U0N2RCO | |
| KEGG | D11045 | |
| Datos químicos | ||
| Fórmula | C19H19N6ClO2 | |
|
InChI=1S/C19H19ClN6O2/c1-11(22-19(28)18-8-17(12(2)27)23-24-18)10-26-6-5-16(25-26)13-3-4-14(9-21)15(20)7-13/h3-8,11-12,27H,10H2,1-2H3,(H,22,28)(H,23,24)/t11-,12?/m0/s1
Key: BLIJXOOIHRSQRB-PXYINDEMSA-N | ||
La darolutamida, que se vende bajo el nombre comercial de Nubeqa, es un medicamento antiandrógeno que se usa en el tratamiento del cáncer de próstata no metastásico resistente a la castración en los hombres. Está específicamente aprobado para tratar el cáncer de próstata no metastásico resistente a la castración (nmCRPC) junto con la castración quirúrgica o médica . El medicamento se toma por vía oral dos veces al día con alimentos.
Los efectos secundarios de la darolutamida añadida a la castración pueden incluir fatiga, astenia, dolor en brazos y piernas y erupción cutánea. La darolutamida es un antiandrógeno no esteroideo (NSAA) y actúa como un antagonista selectivo del receptor de andrógenos (AR). Se le ha denominado como NSAA de segunda o tercera generación.
La darolutamida se patentó en 2011 y se aprobó para uso médico en julio de 2019.
Usos médicos
La darolutamida está aprobada para su uso simultáneamente con un agonista o antagonista de la hormona liberadora de gonadotropina (GnRH) o con una orquiectomía bilateral en el tratamiento del cáncer de próstata resistente a la castración no metastásico (nmCRPC, por sus siglas en inglés) en hombres. Se usa en una dosis de 600 mg por vía oral dos veces al día (1.200 mg/día total) con comida. En individuos con insuficiencia renal grave o insuficiencia hepática moderada, darolutamida se usa a una dosis de 300 mg por vía oral dos veces al día (600 mg/día total) con comida. No se necesita un ajuste de dosis para insuficiencia renal leve a moderada o insuficiencia hepática leve, mientras que se desconoce el ajuste de dosis apropiado para la enfermedad renal en etapa terminal y la insuficiencia hepática grave.
Formularios disponibles
La darolutamida se suministra en forma de comprimidos recubiertos de película oral de 300 mg.
Contraindicaciones
Darolutamide no tiene contraindicaciones en hombres. Sin embargo, el medicamento puede tener efectos teratogénicos en fetos masculinos debido a sus efectos antiandrogénicos y, por lo tanto, no debe ser utilizado por mujeres embarazadas.
Efectos secundarios
Los efectos secundarios más comunes de la darolutamida en ensayos clínicos (≥2% de incidencia) en hombres castrados incluyeron fatiga y astenia (16% frente a 11% para placebo ), dolor en las extremidades (6% frente a 3% para placebo) y erupción cutánea (3% vs. 1% para placebo). La darolutamida también se asoció con una mayor incidencia de cardiopatía isquémica (4,0% frente a 3,4% para placebo) e insuficiencia cardíaca (2,1% frente a 0,9% para placebo). En términos de anormalidades en las pruebas de laboratorio, la darolutamida se asoció con una disminución en el recuento de neutrófilos (20% frente a 9% para el placebo), aumento de aspartato aminotransferasa (AST) (23% frente a 14% para el placebo; Grado 3–4: 0.5% vs. 0.2% para placebo) y aumento de bilirrubina (16% vs. 7% para placebo). En los estudios clínicos, el 88% de los pacientes tratados con darolutamida tenían 65 años o más.
No se han observado convulsiones con darolutamida en ensayos clínicos. La darolutamida es un teratógeno esperado y tiene un riesgo teórico de defectos congénitos en bebés varones si la toman las mujeres durante el embarazo. Puede afectar la fertilidad masculina. Cuando se usa como monoterapia (es decir, sin castración quirúrgica o médica) en hombres, se sabe que los NSAAs producen cambios mamarios feminizantes, que incluyen sensibilidad mamaria y ginecomastia.
Sobredosis
La darolutamida se ha estudiado en dosis de hasta 1800 mg/día en ensayos clínicos. No se observaron toxicidades limitantes de la dosis con esta dosis. Debido a su absorción saturable y la falta de toxicidad aguda, no se espera que una sobredosis de darolutamida produzca toxicidad sistémica en personas con función hepática y renal intactas No existe un antídoto específico para la sobredosis de darolutamida. En caso de sobredosis de darolutamida, si no hay toxicidad, el tratamiento puede continuar de manera normal. Si hay sospecha de toxicidad, se deben tomar medidas generales de apoyo hasta que la toxicidad clínica haya disminuido o se haya resuelto y entonces podrá continuarse el tratamiento.
Interacciones
La glicoproteína P combinada y los inductores potentes o moderados de CYP3A4, como la rifampicina, pueden disminuir la exposición a la darolutamida, mientras que la glicoproteína P combinada y los inhibidores potentes de CYP3A4, como el itraconazol, pueden aumentar la exposición a la darolutamida. La darolutamida es un inhibidor del transportador de la proteína de resistencia al cáncer de mama (BCRP) y puede aumentar la exposición a sustratos para esta proteína, como la rosuvastatina. Se ha encontrado que aumenta la exposición a rosuvastatina en aproximadamente 5 veces.
Farmacología
Farmacodinámica
La darolutamida es un antiandrógeno no esteroideo de segunda o tercera generación (NSAA). Actúa como un antagonista silencioso competitivo selectivo del receptor de andrógenos (AR), el objetivo biológico de los andrógenos como la testosterona y la dihidrotestosterona (DHT). Su afinidad (K i ) por el AR es 11 nM y su inhibición funcional ( IC50 ) del AR es 26 nM. El principal metabolito de darolutamide, cetodarolutamide, tiene semejante actividad antiandrogénica en relación con darolutamida (K I = 8 nM; IC 50 = 38 nM). Además de sus acciones como antagonista de AR, se ha descubierto que la darolutamida actúa como un antagonista silencioso del receptor de progesterona (PR), con aproximadamente el 1% de la potencia de su antagonismo de AR.
Una dosis de darolutamida de 1.200 mg día se ha encontrado que produce una disminución media en los niveles de antígeno prostático específico (PSA) de más del 90% en hombres con cáncer de próstata. [cita requerida] Se ha descubierto que la adición de darolutamida a la castración disminuye los niveles de PSA en más del 50% en aproximadamente el 50% de los hombres a 200 mg /día, 69% de los hombres a 400 mg/día, 83% de los hombres a 1.200 mg/día, y el 86% de los hombres a 1.400 mg/día
La darolutamida muestra algunas ventajas en comparación con la enzalutamida y la apalutamida, otros dos NSAAs de segunda generación. Parece cruzar de manera insignificante la barrera hematoencefálica y, por lo tanto, ha reducido el riesgo de convulsiones y otros efectos secundarios centrales de la inhibición del receptor GABA A fuera del objetivo. De acuerdo con su penetración central disminuida, la darolutamida no parece aumentar los niveles de testosterona. Se ha descubierto que la darolutamida bloquea la actividad de todos los AR mutantes probados/conocidos en el cáncer de próstata, incluida la mutación F876L clínicamente relevante recientemente identificada que produce resistencia a la enzalutamida y la apalutamida. El medicamento muestra una mayor afinidad y potencia inhibitoria en la AR en relación con la enzalutamida y la apalutamida in vitro (K i = 11 nM en relación con 86 nM para enzalutamida y 93 nM para apalutamida; IC50 = 26 nM en relación con 219 nM para enzalutamida y 200 nM para apalutamida).
La darolutamida inhibe los transportadores de polipéptidos transportadores de aniones orgánicos (OATP) OATP1B1 y OATP1B3 in vitro . No muestra la inhibición o inducción de las enzimas del citocromo P450 ( CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1, 3A4 ) a concentraciones clínicamente relevantes. Del mismo modo, darolutamide no muestra inhibición de una variedad de otros transportadores ( P-glicoproteína, MRP2, BSEP, OAT, PTU, compañeros, OATP2B1, PNCT ) a concentraciones terapéuticas.
Farmacocinética
La biodisponibilidad absoluta de darolutamida con la administración oral de una dosis única de 300 mg sin alimentos es aproximadamente del 30%. La biodisponibilidad de darolutamida aumenta aproximadamente de 2 a 2,5 veces cuando se administra con alimentos, con un aumento similar en la exposición a la cetodarolutamida. La exposición a la darolutamida y la cetodarolutamida aumenta de forma casi lineal o proporcional a la dosis en un rango de dosis de 100 a 700 mg (o aproximadamente 0,17 a 1,17 veces la dosis recomendada de 600 mg). No se observó un aumento adicional en la exposición a darolutamida a una dosis de darolutamida de 900 mg dos veces al día (o 1.5 veces la dosis recomendada de 600 mg), lo que indica una saturación de absorción a dosis superiores a 700 mg. Después de una dosis única de 600 mg de darolutamida, los niveles máximos de darolutamida ocurren después de aproximadamente 4 horas Los niveles de darolutamida en estado estacionario ocurren después de 2 a 5 días de administración continua con alimentos, durante los cuales se produce una acumulación aproximada de 2 veces en los niveles de darolutamida. En estado estacionario con 600 mg/día de darolutamida, los niveles medios de darolutamida son 4.79 μg/ml y niveles de darolutamida en el área bajo la curva a lo largo del tiempo 0 a 12 horas (AUC 0–12 ) son 52.82 h • μg/ml. La exposición total a la cetodarolutamida es aproximadamente 1.7 veces mayor que la de la darolutamida.
El volumen de distribución de darolutamida con administración intravenosa es 119 L. La unión a proteínas plasmáticas de darolutamida es del 92%, con un 8% circulando libremente, y de la cetodarolutamida es del 99,8%, con un 0,2% circulando sin unir. Como tal, los niveles libres de darolutamida en la circulación son aproximadamente 40 veces más altos que los de la cetodarolutamida. Tanto la darolutamida como la cetodarolutamida están unidas principalmente a la albúmina. La darolutamida y la cetodarolutamida parecen cruzar de manera insignificante la barrera hematoencefálica tanto en ratones como en humanos.
La darolutamida se metaboliza principalmente en cetodarolutamida por deshidrogenación por CYP3A4 en el hígado . El medicamento también se conjuga mediante glucuronidación por UGT1A9 y UGT1A1. Se ha informado que la vida media de eliminación de darolutamida y cetodarolutamida es de aproximadamente 20 horas. Un estudio clínico encontró que la vida media de eliminación de darolutamida y cetodarolutamida en estado estacionario fue de 15.8 horas y 10.0 horas, respectivamente, con estas semividas independientes de la dosis en un rango de dosis de darolutamida de 200 a 1,800 mg/día. La vida media de eliminación de darolutamida es mucho más corta que la de enzalutamida (p. Ej., 1.6 horas vs. 18.3 horas en ratones). El aclaramiento de darolutamida después de la administración intravenosa es 116 mL/min.
Después de una dosis oral única de darolutamida, más del 95% de la dosis se excreta en orina y heces dentro de una semana después de la administración. Un total de 63.4% de material relacionado con darolutamida se recupera en la orina (aproximadamente 7% como darolutamida sin cambios) y un total de 32.4% de material relacionado con darolutamida (aproximadamente 30% como darolutamida sin cambios) se recupera en las heces.
No se han observado diferencias clínicamente significativas en la farmacocinética de darolutamida en hombres con nmCRPC en función de la edad (48 a 95 años), raza (blanco, asiático, negro), insuficiencia renal de leve a moderada o insuficiencia hepática leve . En individuos que no son nmCPNM con insuficiencia renal grave que no están en diálisis, la exposición a darolutamida se incrementó en aproximadamente 2,5 veces en comparación con las personas sanas. En individuos que no son nmCRPC con insuficiencia hepática moderada, la exposición a darolutamida aumentó aproximadamente 1.9 veces en comparación con los controles sanos. La farmacocinética de darolutamida no se ha evaluado en la enfermedad renal en etapa terminal o la insuficiencia hepática grave.
Química
La darolutamida es un compuesto no esteroideo y es estructuralmente distinto de otros NSAAs comercializados, como la enzalutamida y la apalutamida.
Historia
La darolutamida fue desarrollada por Orion Corporation y Bayer HealthCare. Orion Corporation solicitó una patente sobre darolutamida en octubre de 2010, y esta patente se publicó en mayo de 2011. La darolutamida entró en la fase I de los ensayos clínicos en abril de 2011, y los resultados del primer estudio clínico de la darolutamida se publicaron inicialmente en 2012 La Administración de Drogas y Alimentos de los Estados Unidos (FDA) aprobó la darolutamida en julio de 2019, bajo la designación de revisión prioritaria de la agencia.
La aprobación se basó en ARAMIS, un ensayo clínico multicéntrico, doble ciego, controlado con placebo en 1,509 pacientes con cáncer de próstata resistente a la castración no metastásico. Los pacientes fueron aleatorizados (2:1) para recibir 600 mg de darolutamida por vía oral dos veces al día (n = 955) o placebo equivalente (n = 554). Todos los pacientes recibieron un análogo de la hormona liberadora de gonadotropina (GnRH) al mismo tiempo o tuvieron una orquiectomía bilateral previa. Doce pacientes con antecedentes de convulsiones anteriores fueron tratados en la sección de la darolutamida.
El objetivo primario fue la supervivencia libre de metástasis (MFS), definida como el tiempo desde la aleatorización hasta la primera evidencia de metástasis a distancia o muerte por cualquier causa dentro de las 33 semanas posteriores a la última exploración evaluable, lo que ocurriera primero. La mediana de MFS fue de 40.4 meses (IC 95%: 34.3, no alcanzado) para pacientes tratados con darolutamida en comparación con 18.4 meses (IC 95%: 15.5, 22.3) para aquellos que recibieron placebo (cociente de riesgos 0.41; IC 95%: 0.34, 0.50 ; p <0,0001). Los datos del sistema operativo no estaban maduros.
Sociedad y cultura
Nombres genéricos
Darolutamide es el nombre genérico del medicamento y su INN y USAN . También es conocido por sus nombres de código de desarrollo ODM-201 y BAY-1841788 .
Nombres de marca
Darolutamide se comercializa bajo la marca Nubeqa.
Disponibilidad
La darolutamida está disponible en los Estados Unidos y Europa.
Investigación
La monoterapia con darolutamida se está estudiando en comparación con la terapia de privación de andrógenos con monoterapia con agonista o antagonista de GnRH en hombres con cáncer de próstata sin tratamiento previo. A partir de 2018, entró en un ensayo clínico de fase II para esta indicación. Se espera que este estudio se complete en 2021 o 2022.
La darolutamida se está estudiando para el tratamiento del cáncer de mama en mujeres. A partir de noviembre de 2019, se encuentra en ensayos clínicos de fase II para esta indicación.
Enlaces externos
- «Darolutamide». Drug Information Portal. U.S. National Library of Medicine.
| Control de autoridades |
|
|---|
-
 Datos: Q25091391
Datos: Q25091391