Peróxido de acetona
| Peróxido de acetona | |
|---|---|

| |
| Nombre químico | 3,3,6,6,9,9- hexametil- 1,2,4,5,7,8- hexaoxaciclononano |
| Fórmula química | C9H18O6 |
| Masa molecular | 222.24 g/mol |
| Velocidad de explosión | 5.300 m/s |
| Punto de fusión | 91 °C, 364 K, 196 °F |
| Punto de ebullición | 97-160 °C |
| Sensibilidad al impacto | muy sensible |
| Sensibilidad a la fricción | muy sensible |
| Número CAS | 17088-37-8 |
El peróxido de acetona (triperóxido de triacetona, peroxiacetona, TATP) es un peróxido orgánico, es una sustancia altamente explosiva que puede fabricarse con productos de uso doméstico. Puesto que sus precursores son de fácil obtención, es normalmente usada por químicos aficionados y fabricantes de explosivos, a menudo para detonadores. Algunas veces se ha usado en Cisjordania y en las bombas de los ataques terroristas de Londres del 7 de julio de 2005 y de París el 13 de noviembre de 2015. El zapato-bomba del terrorista Richard Reid iba cargado con más de 100 g de TATP plastificado. En sólo una redada en 1998, las fuerzas de seguridad de la Autoridad Palestina descubrieron 800 kg de TATP en un garaje en Nablús. Los perros de los artificieros pueden ser entrenados para detectar la acetona residual en el TATP.
Consideraciones de seguridad: La peroxiacetona es altamente sensible a la temperatura, fricción e impacto. Incluso químicos profesionales han resultado heridos al intentar usarla así pues bajo ningún concepto lleve a cabo la síntesis del compuesto, incluso teniendo la formación para hacerlo.
El peróxido de acetona fue descubierto en 1895 por Richard Wolffenstein (Chemische Berichte 28, 2265 (1895)). Más información sobre el compuesto, incluyendo las proporciones relativas de monómero, dímero y trímero está disponible en el Journal of the American Chemical Society 81, 6461 (1959). Otras fuentes incluyen estructura cristalina y análisis tridimensional en The Chemistry of Peroxides edited by Saul Patai (pp. 396–7), y también en el Textbook of Practical Organic Chemistry de Vogel.
Química
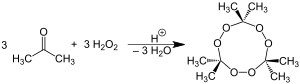
También conocida como "peroxiacetona", el peróxido de acetona se refiere generalmente al compuesto cíclico trímero TCAP (peróxido de acetona tricíclico, o triciclo), también denominado triperóxido de triacetona (TATP), obtenido de la mezcla de peróxido de hidrógeno con acetona y usando pequeñas cantidades de ácido (mencionado anteriormente) como catalizador.
El dímero cíclico (C6H12O4), el monómero abierto y el dímero también se forman, pero con las condiciones apropiadas el trímero cíclico es el producto primario. En condiciones medianamente ácidas o neutras, la reacción es mucho más lenta y produce más peróxido monomérico que la reacción en presencia de un ácido fuerte catalizador. El peróxido de acetona normalmente deflagra, en contacto con una llama, sin estar confinado en cantidades menores de alrededor de 2 g. Por encima de esta cantidad lo normal es que detone, aunque incluso un ligero confinamiento puede facilitar la detonación en menores cantidades. Completamente seca la peroxiacetona es mucho más propensa a detonar en contraposición al producto fresco todavía húmedo con agua o acetona. La oxidación que ocurre cuando arde viene dada por la ecuación estequiométrica:
La sensibilidad extrema al impacto, fricción y temperatura es debida a la inestabilidad de la molécula. Como todos los materiales energéticos, la peroxiacetona libera energía tras la iniciación porque los productos formados por la desintegración y recombinación de sus componentes moleculares (en el caso de la peroxiacetona, tres moléculas de acetona y una de ozono) son más estables que la molécula original. Obviamente la siguiente analogía es sólo parcial, pero imagine la peroxiacetona como una pila de bloques. Si las pilas de bloques (o moléculas) están más cerca entre ellas, la energía liberada causa que las moléculas vecinas caigan en una reacción en cadena. Cuando esta reacción se propaga supersónicamente, la peroxiacetona detona. Estudios recientes describen la descomposición de la peroxiacetona como una explosión entrópica.
Muchas personas han muerto o han resultado con daños permanentes en accidentes causados por el peróxido de acetona. Existe el mito de que la única peroxiacetona segura es el trímero, fabricado a bajas temperaturas, motivo por el que tiene que fabricarse en bancos de hielo de ácido nitroso:
"Si uno está haciendo peroxiacetona, la temperatura debe ser menor de 10°C en todo momento, de otra forma el producto formado contendrá peróxido de dicicloacetona que es tan inestable y sensible que no tiene uso en el campo de los explosivos: el peróxido de dicicloacetona explota espontáneamente".
En realidad, la oxidación de la acetona catalizada en medio ácido, siempre produce una mezcla de las formas dímeras y trímeras. El trímero es la forma más estable, pero no mucho más que la dímera. Todas las formas de peroxiacetona son muy sensibles a la iniciación y se degradan en el almacenamiento a largo plazo, de forma que sólo es usada como explosivo por aficionados curiosos y fuerzas no convencionales (guerrillas, terroristas). Tampoco ninguna forma de peroxiacetona explota realmente de forma espontánea.
Véase también
Enlaces externos
- ATF - List of Explosive Materials (en inglés)
- Science takes on the Mother of Satan (en inglés)
- The mechanics of a living bomb (en inglés)
- Synthesis of Acetone Peroxide (en inglés)
- Milas, Nicholas A.; Goluvobic, Aleksander (1959). «Studies in Organic Peroxides. XXVI. Organic Peroxides Derived from Acetone and Hydrogen Peroxide». J. Am. Chem Soc. 81 (24): 6461-6462. doi:10.1021/ja01533a033.
| Control de autoridades |
|
|---|
-
 Datos: Q329022
Datos: Q329022
-
 Multimedia: Acetone peroxide / Q329022
Multimedia: Acetone peroxide / Q329022