Nivalenol
| Nivalenol | ||
|---|---|---|

| ||
| Nombre IUPAC | ||
| (1S,2R,3S,7R,9R,10R,11S)-3,10,11-trihidroxi-2-(hidroximetil)-1,5-dimetilespiro[8-oxatriciclo[7.2.1.02,7]dodec-5-eno-12,2'-oxirano]-4-ona | ||
| General | ||
| Fórmula estructural |

|
|
| Fórmula molecular | C15H20O7 | |
| Identificadores | ||
| Número CAS | 23282-20-4 | |
| ChEBI | 7599 | |
| ChemSpider | 29515 | |
| PubChem | 31829 | |
| UNII | 5WOP02RM1U | |
| KEGG | C06080 | |
|
CC1=C[C@H]2O[C@@H]3[C@H](O)[C@@H](O)[C@@](C)([C@]34CO4)[C@@]2(CO)[C@H](O)C1=O
| ||
| Propiedades físicas | ||
| Masa molar | 312,31 g/mol | |
| Propiedades químicas | ||
| Acidez | 11,78 pKa | |
| Peligrosidad | ||
| SGA |
  
|
|
| NFPA 704 |
3
1
0
|
|
| Temperatura de autoignición | 525 K (252 °C) | |
| Frases H | H225, H300, H302, H312, H332, H310, H319, H330 | |
| Frases P | P210, P241, P260, P262, P264, P270, P271, P280, P284, P301+310, P302+350, P304+340, P310, P320, P321, P322, P330, P361, P363, P403+233, P405, P501 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Nivalenol (NIV) es una micotoxina del grupo de Tricoteceno. En la naturaleza se encuentra principalmente en hongos de las especies de Fusarium. Las especies de Fusarium pertenecen a las micotoxinas más frecuentes que producen hongos en las regiones templadas del hemisferio norte, por lo que los hacen un riesgo considerable para la industria de la producción de cultivos de alimentos.
Los hongos son abundantes en varios productos agrícolas (cultivos de cereales) y sus productos procesados adicionales (malta, cerveza y pan). Las especies de Fusarium invaden y crecen en cultivos, y pueden producir nivalenol bajo condiciones húmedas y frías.
Los síntomas observados después de ser afectados con el nivalenol son 'rechazos de alimento, vómitos, irritación gastroentérica y dérmica o necrosis y disfunción inmunológica', así como la hematotoxicidad, lo que resulta en un recuento de leucocitos bajo.
Historia
En el período de 1946-1963, se reportaron varios casos de intoxicación debido a la ingestión de granos infectados a Fusarium (enfermedad de granocrabbecing) en Japón, Corea e India. No ha habido informes de casos letales y solo síntomas leves como náuseas, vómitos, diarrea y dolor abdominal. En estos incidentes se pudo aislar F. graminaerum, lo que sugiere una contaminación con nivalenol o deoxinivalenol.
En el mismo período, se informaron dos brotes que involucran más de 100 casos en India y China. Estos brotes tampoco fueron letales.
Un brote bien documentado y agudo en la India en 1987 afectó a alrededor de 50 000 mil personas. Varias toxinas de Fusarium bajo las cuales fueron encontrados nivalenol (0,03–0,1 mg/kg en 2 de 24 muestras), deoxinivalenol (0,34–8,4 mg/kg en 11 de 24 muestras) y acetildeoxinivalenol (0,6–2,4 mg/kg en 4 de 24 muestras) en el trigo dañado por la lluvia utilizado para la producción de pan. Nuevamente, no hubo casos letales y los síntomas informados fueron dolor abdominal, diarrea, heces sangrientos y vómitos. Estos casos muestran que el principal peligro emergente del nivalenol proviene de los cereales infectados con Fusarium y se produce principalmente a través de la ruta de la digestión de trigo incontrolado u otros granos que se procesan adicionalmente o ingresan a la cadena alimentaria a través de otra ruta.
Arma y otros casos de envenenamiento de nivalenol
El nivalenol, así como la toxina desoxinivalenol y T-2 se han utilizado como agentes de guerra biológica en Laos y Camboya, así como en Afganistán. Se ha alegado que la Unión Soviética proporcionó las micotoxinas y las utilizó en Afganistán.. Los tres compuestos podían identificarse en la vegetación en los sitios afectados, mientras que la toxina T-2 también podía encontrarse en las muestras de orina y sangre de las víctimas.
El uso mejor documentado de tricotecenos en la guerra es la controversia de la lluvia amarilla, esto describe una serie de ataques en el sudeste de Asia, así como a Laos y Afganistán, que utilizaron una "lluvia amarilla" según lo descrito por los testigos. Las toxinas se entregaron como lo que se ha descrito como una nube de polvo o gotitas amarillas. Un artículo de L. R. Ember publicado en 1984 en Noticias de Ingeniería Química describe el uso de micotoxinas de tricoteceno como armas biológicas en el sudeste asiático de una manera muy detallada. En informes de TI, informes de sobrevivientes y testigos presenciales, así como los prisioneros de guerra y los informantes soviéticos, se pueden encontrar junto con la información sobre la presencia de técnicos y laboratorios soviéticos. Esto llevó a la conclusión de que estas toxinas se han utilizado en el sudeste asiático y Afganistán. El gobierno ruso, sin embargo, se niega a dar una declaración sobre estas pruebas. Además, se ha demostrado que las muestras tomadas en la ubicación de los ataques contienen estas toxinas, mientras que los sitios que no han sido atacados no muestran signos de toxinas en ellos.
Aunque sigue siendo cuestionable si todos los informes de testigos son fuentes de evidencia confiables, los síntomas registrados son típicos de intoxicación con tricotecenos.
Hubo varias formas en que las tricotecenos estaban armonizadas, como la dispersión como aerosol, el humo, las gotitas o el polvo de las aeronaves, los misiles, los dispositivos de mano o la artillería.
Directrices de seguridad en la industria alimentaria
En el año 2000, la Comisión Científica de Alimentación (SCF) emitió una opinión científica sobre Nivalenol. Se emitió una ingesta diaria tolerable temporalmente (T-TDI) de 0-0.7 μg / kg por día por día después de la evaluación de la toxicidad general, así como la hematoxicidad y la inmunotoxicidad. Este T-TDI fue reafirmado por el SCF en 2002.
En 2010, la Comisión de Seguridad Alimentaria Japonesa (FSCJ) emitió un T-TDI de 0.4 μg / kg BW por día.
Entre 2001 y 2011, la Autoridad Europea de Seguridad Alimentaria (EFSA) recopiló datos de 15774 ocurrencias de los nivalenoles en 18 países europeos a evaluar. Esto llevó al establecimiento de un TDI de 1.2 μg / kg de bw por día. El nivalenol estaba en estos estudios, no se encontró que era genotóxico, pero bien hematotóxico e inmunotóxico.
Estructura y reactividad
El nivalenol como parte de la familia de micotoxinas tiene la estructura común que tienen todos los miembros de esta familia de toxinas. Esto incluye la estructura básica de un ciclohexeno y un anillo tetrahidropirano conectado a C6 y C11. Además, un grupo de etilo conecta el tetrahidropirano en C2 y C5 y un grupo de ceto se adjunta en el ciclohexeno en C8. El grupo epóxido, responsable de la reactividad para la mayoría de las partes, se adjunta en C12 y C13 en el tetrahidropirano. Solo los grupos restantes en las posiciones C3, C4, C7, C15 varían para las diferentes micotoxinas. En el caso de Nivalenol, cada uno de los cuatro grupos restantes es un grupo hidroxilo sustituido que se suma a la reactividad en presencia de compuestos hidrófilos o subgrupos, respectivamente, gracias a sus características polares. En medio ácido, el grupo Keto es capaz de reaccionar con un protón que promueve la polaridad y la reactividad también. Pero en conjunto el grupo epóxido es crucial para la reactividad de la molécula.
Formas disponibles
El nivalenol, el deoxinivalenol y la toxina T2 son las tres micotoxinas sintetizadas estructurales y similares que aparecen de forma natural en los hongos. (por ejemplo, Fusarium).
Síntesis
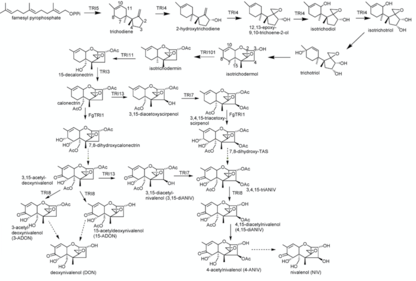
La síntesis de Nivalenol es un proceso de 16 pasos. Puede diferir en el Paso 11 al Paso 14 Dependiendo del orden en que la reacción que controla los sintoness de tricodieno TRI1, TRI13 y TRI7 estén catalizando. El farnesilo pirofosfato se utiliza como compuesto de partida para la síntesis de nivalenol. Su reacción de ciclación a tricodieno está catalizada por Terpene Cycase Trichodiene Synthase (TRI5). Esta reacción es seguida por varias reacciones de oxidación catalizadas por citocromo P450 monooxigenasa (codificado por TRI4). De este modo, los grupos hidroxilo se sustituyeron a los átomos de carbono C2, C3 y C11 y un oxígeno se añadieron a C12 y C13 facilitando la formación de un grupo epóxido. Esto resulta en el isotrichotriol intermedio.
En una reacción adicional, el tricotriol se ganó a través de un cambio del grupo hidroxilo C11 del isotrichotriol al C9, similar, el doble enlace se desplazó de C9 = C10 a C10 = C11. El tricotriol reacciona en una reacción de ciclación no enzimática a su isotrichodermol isómero. En la reacción, el grupo hidroxilo en el C2 del ciclopentano se une al C11 del ciclohexeno que forma un anillo tetrahidropirano. El grupo OH desplazado en C9 se pierde durante la reacción. Una acetiltransferasa (codificada por TRI101) cataliza la acetilación del grupo OH C3 de isotrichodermol formando isotrichdermin.
La isotricodermina se convierte en 15-decalonecitrina debido a una sustitución (codificada por TRI11) de un hidrógeno por un hidroxilo en C15, que luego se acetiliza con ayuda de TRI3. La misma sustitución y las siguientes reacciones de acetilación ocurren en C4 nuevamente bajo el control de TRI13 y TRI7. TRI1 en F. sporotrichiodies cataliza aún más la adición de un cuarto OH-Group en C8 y un quinto grupo OH en C7 en el que se elimina el hidrógeno y se forma un grupo de keto.
En un último paso, una esterasa controlada por TRI8 cataliza la desacetilación en C3, C4 y C15, lo que resulta en el producto final Nivalenol. Una síntesis parcialmente alternativa puede ocurrir cuando los catalizadores TRI1 y TRI13, TRI7 se utilizan en orden opuesto. Luego, la adición de los grupos hidroxilo en C7 y C8 controlada por TRI1 está sucediendo con calonectrina como reactante. En esta reacción se forma 7,8-dihidroxicalonecalonetrina. Reacciona aún más espontáneamente a 3,15 acetil-deoxinivalenol por eliminación de un hidrógeno y formación de un keto-grupo en C8. La adición de un grupo hidroxilo en C4 controlado por TRI13 se produce y se acetiliza bajo la ayuda de TRI7. Esto produce 3,4,15-triacetilnivalenol (3,4,15-trianiv) desde donde está de nuevo la misma síntesis que se describe anteriormente.