Moléculas gaseosas de señalización
Las moléculas gaseosas de señalización son compuestos gaseosos usados por organismos, tejidos o células para transmitir señales químicas que inducen cambios fisiológicos o bioquímicos en el organismo; este puede sintetizar las moléculas señalizadoras internamente o importarlas del exterior. Ejemplos de moléculas gaseosas señalizadoras son el oxígeno, el dióxido de carbono, los óxidos de nitrógeno y el amoniaco entre muchas otras.
A muchas, pero no a todas de las moléculas gaseosas de señalización se las conoce como gasotransmisores.
Gasotransmisores
Los gasotransmisores son una subfamilia de moléculas endógenas de gases o moléculas gaseosas de señalización, que incluye el óxido nítrico (NO), el monóxido de carbono (CO) y el ácido sulfhídrico (H2S). Estos gases tienen algunas características únicas que las diferencia de otras moléculas clásicas de señalización. En 1981, se sugirió por primera vez en un estudio clínico con óxido nitroso que los gases podían tener una acción directa en los receptores farmacológicos y por ende actuar como neurotransmisores. Los experimentos in vitro confirmaron estas observaciones, reproducidas posteriormente.
La terminología y criterios de caracterización de un gasotransmisor fueron introducidos por primera vez en el 2002. Para categorizar una molécula de gas como un gasotransmisor, deben cumplirse las siguientes condiciones:
- Es una molécula pequeña;
- Es capaz de penetrar pasivamente la membrana celular, por lo que sus actividad no depende de los receptores de membrana. Puede tener efectos endocrinos, paracrinos y autocrinos. Un gasotransmisor endocrino, por ejemplo, puede entrar en el flujo sanguíneo y ligarse a moléculas transportadoras; y una vez alcanzado la célula de destino, modular funciones biológicas.
- Se genera de manera endógena y enzimática, y su producción está regulada;
- Tiene funciones específicas y bien definidas en concentraciones fisiológicas relevantes. La alteración de los niveles endógenos del gas provoca cambios fisiológicos específicos;
- Las funciones del gas endógeno son las mismas que las de la misma molécula introducida exógenamente;
- Sus efectos celulares pueden o no ser mediados por mensajeros secundarios, pero tienen blancos específicos a nivel celular y molecular.
Dióxido de carbono
El dióxido de carbono (CO2) es uno de los mediadores de la autorregulación local del suplemento sanguíneo. Si sus niveles son altos, los capilares se expanden para permitir un flujo sanguíneo mayor a los tejidos.
Los iones de bicarbonato son cruciales para la regulación del pH en la sangre. La tasa de respiración de una persona influencia el nivel de CO2 en su sangre. Una respiración muy lenta o pausada causa acidosis respiratoria, mientras que la respiración muy rápida conduce a la hiperventilación y alcalosis respiratoria.
A pesar de que el cuerpo requiere oxígeno para el metabolismo, no son los niveles bajos de oxígeno los que normalmente estimulan la respiración, sino los niveles altos de dióxido de carbono. Los centros respiratorios tratan de mantener una presión arterial de CO2 de 40 mm Hg. Cuando hay hiperventilación intencional, el contenido de CO2 en las arterias puede disminuir de 10-20 mm Hg sin afectar el contenido de oxígeno en la sangre, y la dinámica respiratoria disminuye. Esta es la razón por la cual una persona puede aguantar la respiración por más tiempo después de hiperventilarse, con el riesgo de quedar inconsciente antes de que tenga la necesidad de respirar; por esto la hiperventilación es particularmente peligrosa antes de bucear.
Óxido nítrico
El óxido nítrico o monóxido de nitrógeno (NO) es un mensajero biológico clave en los vertebrados al desempeñar un papel importante en una variedad de procesos biológicos. A pesar de su toxicidad, es un producto secundario del metabolismo que se ha encontrado en casi todos los tipos de organismos, desde las bacterias a las plantas, hongos y células animales.
Función de vasodilatación
El NO es conocido como el «factor de relajación derivado del endotelio» o ENDRF (siglas en inglés). En su biosíntesis a partir de L-arginina, oxígeno, y NADPH participa la enzimas óxido nítrico sintetasa (NOS). La reducción del nitrato inorgánico puede servir para hacer óxido nítrico. El endotelio (capa interna) de los vasos sanguíneos usa óxido nítrico para dar la señal al músculo liso circundante de relajarse, lo que tiene como resultado la vasodilatación y en el aumento del flujo sanguíneo. Por ser un radical libre, el NO es muy estable y la molécula solo se mantiene libre unos pocos segundos, aunque incluido en ese corto tiempo logra cruzar la membrana celular. Esto hace que el óxido nítrico pueda funcionar como pasajero paracrino entre células adyacentes y como molécula de señalización autocrina en la misma célula.
Independientemente de la enzima de óxido nítrico sintetasa, una ruta alternativa, conocida como la ruta del nitrato-nitrito-óxido nítrico, eleva el óxido nítrico mediante la reducción secuencial del nitrato presente el la dieta. Se ha demostrado que la ingesta de alimentos vegetales ricos en nitrato, en particular los de hoja verde, como la espinaca y la arúgula incrementa los niveles cardioprotectivos del óxido nítrico con una reducción correspondiente en la presión sanguínea en las personas que padecen de prehipertensión arterial. Aunque los vertebrados no poseen las enzimas capaces de catalizar la reducción del nitrato al nitrito, las bacterias comensales presentes en la boca realizan esta reacción. Los análisis de saliva pueden detectar la bioconversión del nitrato derivado de las plantas en óxido nítrico y las propiedades antihipertensivas de la dieta.
La producción de óxido nítrico es elevada en poblaciones que viven a altitudes muy por encima del nivel del mar, lo cual ayuda a evitar hipoxia al asistir en la vasodilatación pulmonaria vascular. Los efectos de una presencia elevada de óxido nítrico incluyen vasodilatación, neurotransmisión, modulación del ciclo del cabello, producción de los intermediarios reactivos del nitrógeno y erecciones. Sustancias como aa nitroglicerina y el nitrito de amilo actúan como vasodilatadores porque producen óxido nítrico en el cuerpo. El medicamento antihipertensivo y vasodilatador minoxidil contiene una fracción de NO y puede actuar como un agonista del NO. De la misma manera, el sildenafilo, conocido con el nombre de marca de Viagra, estimula primordialmente las erecciones al mejorar la señalización en la ruta de óxido nítrico en el pene.
El óxido nítrico (NO) contribuye a la homeostasis de los vasos sanguíneos al inhibir las contracciones del músculo liso vascular y su crecimiento, al agregar plaquetas, y promover la adhesión de leucocitos al endotelio. Las personas con ateroesclerosis, diabetes o hipertensión comúnmente muestran alteraciones en el metabolismo del NO. Se ha demostrado que el alto consumo de sales disminuye la producción de NO en pacientes con hipertensión esencial.
Función en la respuesta inmune
El óxido nítrico también forma parte de la respuesta inmune e inflamatoria. La enzima óxido nítrico sintetasa o iNOS se expresa en los fagocitos (monocitos, macrofagos, y neutrófilos); El interferón gamma (IFN-γ) y un factor de necrosis tumoral (TNF) pueden activar a la iNOS, mientras que el factor de crecimiento transformante beta (TGF-β) y las interleucinas-4 (IL-4) e IL-10 la inhiben. De este modo, el sistema inmune puede regular la repuesta de los fagocitos a la infección.
El óxido nítrico es tóxico para las bacterias y los parásitos intracelulares, como Leishmania y Plasmodium, causante de la malaria. El NO daña el ADN y descompone los centros de hierro-sulfuro en iones de hierro y compuestos metal nitrosilos. Como respuesta, muchos patógenos bacterianos han desarrollado mecanismos de resistencia al óxido nítrico.
Dado que el óxido nítrico puede tener una acción proinflamatorias en enfermedades como el asma, se ha empezado a estudiar la medida del óxido nítrico exhalado para examinar la inflamación de las vías respiratorias. En general, un nivel alto del NO en el aliento se asocia con la exposición a la contaminación del aire, aunque en ciclistas y fumadores el efecto es el contrario.
Otras funciones
El óxido nítrico puede contribuir al daño por reperfusión después de un episodio de isquemia: el NO, que aparece en grandes cantidades durante la reoxigenación, reacciona con el superóxido para producir el oxidante peroxinitrito, capaz de atacar numerosas moléculas vitales par la célula, como las proteínas y el ADN. En contraste, la inhalación de óxido nítrico ayuda a sobrevivir y a recuperarse del envenenamiento con paraquat, un herbicida altamente tóxico que daña los tejidos pulmonares e interfiere en el metabolismo de NOS.
En las plantas
Las plantas pueden producir NO por una de las siguientes rutas metabólicas:
- por la enzima óxido nítrico sintetasa dependiente de la L-arginina, (aunque la existencia de Homología (biología) del NOS animal en las plantas aún esté en debate);
- por la enzima nitrato reductasa vinculada a la membrana plasmática;
- en la cadena mitocondrial de transporte de electrones;
- por reacciones no enzimáticas.
En los vegetales funciona como una molécula de señalización, actúa principalmente en contra del estrés oxidativo y también desempeña un papel importante en las interacciones de la planta con un patógeno. Las plantas o flores cortadas tratadas con óxido nítrico tardan más tiempo en marchitarse.
Mecanismo de actuación
Se han hallado múliples mecanismos por los que el NO afecta la biología de las células. Entre ellos se cuentan la S-nitrosación de los tioles, y la nitrosilación de los iones metálicos de transición. En la S-nitrosación se da la conversión reversible conversión de los grupos tioles, como el aminoácido cisteína presente en las proteínas, para formar S-nitrosotiol (RSNOs). La S-nitrosación en un mecanismo dinámico, de regulación postraduccional de la mayoría de las clases de proteínas. En lo que respecta a la nitrosilación de metales, el ejemplo típico es la nitrosilación del un grupo hemo como ocurre en los citocromos, lo cual inhabilita la función enzimática normal de la proteína. El hierro nitrosilado es particularmente estable, ya que el enlace entre el ligando nitrosil y el hierro Fe(II) es muy fuerte. La hemoglobina es un ejemplo notable de hemoproteína que puede ser modificada por NO mediante ambos mechanismos: el NO puede vincularse al grupo hemo por nitrosilación,o formar S-nitrosotiol por S-nitrosación de los grupos tiol.
El NO promueve la relajación del músculo liso mediante la estimulación de la enzima heterodimérica soluble guanilato ciclasa y la formación consiguiente de guanosín monofosfato (GMP) cíclico. El GMP cíclico activa a su vez a la proteína quinasa G, lo que causa un incremento de Ca2+ y la apertura de los canales de potasio activados por calcio. La caída en la concentración de Ca2+ asegura que la quinasa de la cadena ligera de la miosina (MLCK) cesa de fosforilar la molécula de miosina, lo que detiene el ciclo con el resultado de la relajación de las células del músculo liso.
Otras reacciones de importancia biológica ne las que interviene el NO son la oxidación de ferroproteínas, como la ribonucleótido reductasa y la aconitasa, la ADP-ribosilación de proteínas, y la activación del factor de regulación del hierro. Se ha demostrado que el NO activa el factor de transcripción NF-κB, presente en las células periféricas mononucleares de la sangre y que es importante para la expresión génica de iNOS en respuesta a la inflamación.
Óxido nitroso
El óxido nitroso N2O puede formarse en los sistemas biológicos por una reducción, ya sea con ayuda de enzimas o sin estas, del óxido nítrico. Los estudios in vitro han mostrado que el óxido nitroso endógeno puede formarse en la reacción entre el óxido nítrico y un tiol. Algunos autores han demostrado que este proceso de reducción de NO a N2O se realiza en los hepatocitos, específicamente en su citoplasma y en la mitocondria. Es bien conocido que varias bacterias producen N2O durante el proceso de desnitrificación.
Además de sus acciones directas e indirectas en los receptores de opio, el N2O también inhibe la actividad mediada por el receptor NMDA y las corrientes iónicas, además de disminuir la exotoxicidad mediada por el receptor NMDA y la neurodegeneración. El óxido nitroso también inhibe a la metionina sintasa y demora la conversión de homocisteína a metionina, lo que incrementa la concentración de la primera y disminuye la de la segunda. Este efecto se observó en los cultivos celulares de linfocitos y en muestras del hígado humano.
Al contrario que el óxido nítrico, el óxido nitroso no se enlaza como un ligando al grupo hemo y no reacciona con proteínas que contienen tioles. No obstante, los estudios han mostrado que el óxido nitroso puede insertarse de manera reversible y no covalente en las estructuras internas de algunas proteínas que contienen grupos hemo como la hemoglobina, mioglobina, citocromo oxidasa y alterar su estructura y función, como demuestran los cambios en el espectro infrarrojo de los tioles de la cisteína en la hemoglobina y la inhibición parcial y reversible de la citocromo oxidasa.
Monóxido de carbono
El monóxido de carbono (CO) es producido endógenamente por los organismos una molécula de señalización. Puede funcionar como un neurotransmisor o un vasodilatador. El CO modula funciones del sistema cardiovascular e inhibe la adhesión y adición de plaquetas en la sangre. Los desórdenes en el metabolismo del CO pueden causar trastornos como neurodegeneración, hipertensión, fallo cardíaco o inflamación.
En los mamíferos, el monóxido de carbono se produce por la acción de la hemo-oxigenasa 1 y 2 en el grupo hemo durante la degradación de la hemoglobina. Este proceso produce una cierta cantidad de carboxihemoglobina, incluso en la ausencia de monóxido de carbono externo.
Tras el primer informe científico en 1993 sobre la función neurotransmisora del CO, y de su papel en las respuestas inflamatoria, esta molécula ha recibido una gran atención clínica como regulador biológico y como antiinflamatorio, vasodilatador, e impulsor del crecimiento neovascular. Estas propiedades tienen el potencial de ser usadas para prevenir el desarrollo de condiciones patológicas incluyendo la reoxigenación de una herida por isquemia, el rechazo de un trasplante, ateroesclerósis, sepsis severas, malaria severa, o autoinmunidad. Se han realizado exámenes clínicos con humanos, sin embargo los resultados no han sido publicados. Por otra parte su uso potencial como agente teurapéutico no estaría exento de problemas, dado que el crecimiento neovascular desempeña un papel también en el crecimiento tumoral y la degeneración macular, una enfermedad que se da unas cuatro o seis veces más frecuentemente en los fumadores, que presentan un nivel de monóxido de carbono en la sangre mucho mayor que el normal.
Dióxido de tricarbono
El dióxido de tricarbono, C3O2, puede producirse en cantidades pequeñas en los mismos procesos bioquímicos que normalmente producen monóxido de carbono, por ejemplo, durante la oxidación de un grupo de hemo por la enzima hemo-oxigenasa 1. También puede formarse a partir del ácido malónico. El dióxido de tricarbono se polimeriza rápidamente formando estructuras macrocíclicas de policarbones con la fórmula común (C3O2)n —mayormente (C3O2)6 y (C3O2)8—; estos compuestos macrocíclicos son inhibidores potentes de las bombas de sodio-potasio y de calcio de la membrana plasmática, y tienen características fisiológicas parecidas a las de la digoxina y propiedades antihipertensivas y natriuréticas. Se piensa además que pueden disminuir la formación de radicales libres y el estrés oxidativo, además de participar en los mecanismos protectivos endógenos anticáncer, por ejemplo en la retina.
Ácido sulfhídrico
El ácido sulfhídrico (H2S) es producido en cantidades pequeñas por algunas células de los mamíferos y tiene numerosas funciones de señalización biológica. Se sintetiza a partir de la cisteína por las enzimas cistetionina beta-sintetasa y cistetionina gamma-liasa. Actúa como relajante en el músculo liso y como vasodilatador y también está en estado activo en el cerebro, en donde incrementa la respuesta del receptor NMDA y facilita la potenciación a largo plazo, un proceso necesario para la formación de la memoria.
La enzima tiosulfato reductasa convierte el compuesto en un sulfito en las mitocondrias. El sulfito a su vez se oxida y se convierte en tiosulfato por acción de la enzima sulfito oxidasa. Los sulfatos se excretan en la orina.
Debido a sus efectos similares a los del óxido nítrico —excepto la capacidad formar peróxidos por medio de la interacción con un superóxido—, el ácido sulfhídrico es reconocido como un protector potencial contra algunas enfermedades cardiovasculares. Las propiedades cardioprotectivas del ajo provienen del catabolismo del grupo polisulfuro en la alicina, donde se produce H2S.
Aunque tanto el óxido nítrico (NO) como el ácido sulfhídrico relajan los vasos sanguíneos, los mecanismos de acción son diferentes: mientras el NO activa la enzima de guanilato ciclasa, el H2S activa los canales de potasio dependientes del ATP en las células del músculo liso. No se sabe con seguridad cómo la función de relajamiento de los vasos sanguíneos son compartidas entre los dos gases, pero existen indicios que sugieren que el óxido nítrico es más activo en los vías sanguíneas mayores, y el ácido sulfhídrico tiene un papel más importante en los vasos sanguíneos más pequeños. Otros descubrimientos recientes sugieren un fuerte solapamiento entre el NO y H2S, y que los efectos vasodilatadores de ambos gases son mutuamente dependientes. Adicionalmente, el H
2S reacciona con el S-nitrosotiol intracelular para formar el S-nitrosotiol (HSNO) más pequeño, y se ha relacionado al ácido sulfhídrico con el control de las reservas intracelulares de S-nitrosotiol. Al igual que el óxido nítrico, el ácido sulfhídrico puede ser un medio terapéutico para la disfunción eréctil.
La deficiencia de H2S puede ser perjudicial para las funciones vasculares después de un infarto agudo de miocardio, El H2S se suministra a los pacientes con infarto agudo mediante un polisulfuro como por ejemplo, el trisulfuro de dialilo (DATS). Las moléculas de H2S atraen al oxígeno, que reacciona con ellas y la enzima óxido nítrico sintetasa endotelial(eNOS) para aumentar la producción de NO en lugar de producir superóxidos Con un aumento en el uso de oxígeno para producir más NO, hay menos disponibilidad de oxígeno para reaccionar con eNOS para producir superóxidos y especies reactivas de oxígeno causantes de estrés oxidativo en las células vasculares del músculo liso. El incremento de la producción de NO promueve la actividad de la guanilato ciclasa soluble y un aumento de la guanosina monofosfato cíclico (cGMP). Esto incrementa la actividad de la proteína quinasa G (PKG), que limita la proliferación celular del músculo liso, reduciendo el engrosamiento seguido de un daño por infarto miocardial.
En la enfermedad de Alzheimer, la concentración de ácido sulfhídrico en el cerebro cerebro disminuye drásticamente. En un modelo de la enfermedad de Parkinson en ratas, se observó que la concentración de ácido sulfhídrico en el cerebro disminuye, y la administración de ácido sulfhídrico alivia la condición. En la síndrome de Down el cuerpo produce un exceso de ácido sulfhídrico. El ácido sulfhídrico interviene también en el proceso de la enfermedad de diabetes tipo 1: las células beta del páncreas en la diabetes tipo 1 producen el gas en exceso, lo que conlleva la muerte de estas células y una producción reducida de insulina.
Inducción de hipotermia
En el 2005, se mostró que es posible inducir un estado de hipotermia parecida a la suspensión de animación en los ratones mediante la administración de una dosis baja de ácido sulfhídrico (81 ppm de H2S) en el aire. La tasa de respiración de los animales disminuyó de 120 a 10 respiraciones por minuto y su temperatura cayó de los 37 °C a solamente 2 °C por encima de la temperatura ambiente. Estos ratones sobrevivieron al procedimiento durante seis meses sin mostrar consecuencias negativas posteriormente. En el 2006 se mostró que la presión sanguínea de los ratones tratados con ácido sulfhídrico no disminuía significantemente.
Un proceso similar conocido como hibernación ocurre naturalmente en muchos mamíferos así como en renacuajos, pero no en ratones. Si fuera posible inducir la hibernación por H2S en los seres humanos, sería útil para tratar pacientes heridos severamente, y para la conservación de órganos donados. En el 2008, una hipotermia de 48 horas inducida por ácido sulfhídrico redujo el daño cerebral causado por un infarto cerebral en las ratas. Se piensa que el ácido sulfhídrico produce estos efectos por desacelerar el matabolismo al enlazarse con la citocromo oxidasa e impedir así la unión de esta proteína con el oxígeno, y que el gas producido de forma natural se usa para regular la actividad metabólica y la temperatura corporal.
Dos estudios arrojaron dudas sobre el efecto alcanzable en mamíferos grandes. Un experimento en 2008 intentó reproducir el efecto de hipotermia corporal en los cerdos, pero fracasó. Otro experimento con ovejas tampoco observó una inducción de hipometabolismo en estos animales. Por otro lado, en 2010, Mark Roth anunció que la hipotermia inducida por el ácido sulfhídrico en humanos había superado las investigaciones clínicas de la Fase 1. Los exámenes clínicos comisionados por la compañía que él ayudó a fundar, Ikaria, concluyeron en agosto del 2011.
Dióxido de azufre
La función del dióxido de azufre (SO2) en la biología de los mamíferos aún no se entiende muy bien, pero se sabe bloquea las señales nerviosas de los receptores pulmonares y elimina el reflejo de inflación Hering-Breuer. El dióxido de azufre endógeno ayuda a reducir el daño pulmonar causado por el ácido oléico al disminuir la peroxidación de lípidos, la formación de radicales libres, el estrés oxidativo y la inflamación. Una menor producción de dióxido de azufre tiene el efecto opuesto. La adición de acetilcisteína o glutatión en la dieta de las ratas incrementa la cantidad de SO2 endógeno producido y disminuye los daños en el tejido pulmonar y la apoptosis celular en estos roedores.
También se cree que el dióxido de azufre endógeno tiene un papel fisiológico significativo en la regulación de las funciones cardíacas y de los vasos sanguíneos; un metabolismo aberrante o deficiente de dióxido de azufre puede contribuir a diferentes enfermedades cardiovasculares, como la hipertensión arterial, la ateroesclerósis,la hipertensión arterial pulmonar y la angina de pecho.
Los niños con hipertensión arterial pulmonar debida a enfermedades cardíacas congénitas presentan un nivel de homocisteína alto y una menor concentración de dióxido de azufre endógeno. Existe una correlación entre estos parámetros bioquímicos y la seriedad de la hipertensión arterial pulmonar y se considera que la homocisteína es un marcador bioquímico útil para determinar la severidad de la enfermedad. La mejora del metabolismo del dióxido de azufre es potencialmente una estrategia terapéutica para estos pacientes.
El dióxido de azufre endógeno rebajar la tasa de proliferación de las células endoteliales del músculo liso en los vasos sanguíneos, mediante la disminución de la actividad de MAPK y la activación de adenilil ciclasa y la proteína quinasa A. La proliferación de las células del músculo liso en un mecanismo importante para modular la hipertensión en los vasos sanguíneos y su estenósis, así que es un importante mecanismo patogenético en la hipertensión arterial y la ateroesclerosis.
El dióxido de azufre endógeno en concentraciones bajas causa una vasodilatación dependiente del endotelio. En concentraciones más altas causa vasodilatación independiente del endotelio y tiene un efecto negativo inotrópico en la función cardíaca, disminuyendo la presión sanguínea y el consumo del oxígeno miocardial. Los efectos de vasodilatación en el dióxido de azufre son mediados mediante los canales de calcio dependientes del ATP y los canales de calcio tipo L ("dihidropiridina"). El dióxido de azufre endógeno es un antiinflamatorio potente, y un agente antioxidante y citoprotectivo.
El dióxido de azufre endógeno también disminuye el daño miocardial causado por la hiperestimulación de isoproterenol adenérgico, y refuerza la defensa antioxidante miocardial de reserva.
Ácido cianhídrico
Algunos autores han mostrado que las neuronas pueden producir ácido cianhídrico tras la activación de los receptores de opio por opiáceos endógenos o exógenos. También han mostrado que la producción neuronal de HCN activa los receptores NMDA y es importante en la transducción de señal entre las células neuronales (neurotransmisión). La producción neuronal de HCN endógeno parece ser necesaria para el efecto analgésico de los opiáceos, que son menos efectivos cuando el HCN disminuye. Se considera al HCN endógeno como un neuromodulador.
También se ha demonstrado que la estimulación de los receptores de muscarínicos colinérgicos en células las de cultivo de feocromocitoma aumenta la producción de HCN. In vivo, por el contrario, la estimulación muscarínica y colinérgica disminuye la producción de HCN. Los leucocitos generan HCN en la fagocitosis.
La producción de HCN endógeno también media junto con el NO en el proceso de vasodilatación mediante la administración de nitroprusiato, que tiene un mayor efecto antihipertensivo —acompañado de mayor toxicidad por el nivel más alto de cianuro en la sangre— en comparación con la nitroglicerina y otros nitratos no cianogénicos.
Amoniaco
El amoniaco (NH3) se biosintetiza a través del metabolismo normal de los aminoácidos y es tóxico en concentraciones altas. El hígado convierte el amoniaco en urea mediante una serie de reacciones conocidas como el ciclo de la urea. La disfunción del hígado, por la cirrosis u otras dolencias, puede conducir a cantidades elevadas de amoniaco en la sangre (hiperamonemia), al igual que los defectos en las enzimas responsables que participan en el ciclo de la urea, como la ornitina transcarbamilasa. La hiperamonemia contribuye a la confusión mental y el coma típicos de la encefalopatía hepática, así como a una enfermedad neuronal común en la gente con defectos en el ciclo úrico y acidurias orgánicas.
El amoniaco es importante para el balance normal animal ácido/base. Después de la formación de amonio por la metabolización del aminoácido glutamina, el ácido α-cetoglutárico puede descomponerse en dos moléculas de bicarbonato, que forman soluciones tampón para neutralizar los ácidos de la dieta. El amonio se dispersa en los túbulos renales, desde donde se excreta tras combinarse con un ion de hidrógeno.
Metano
Varios investigadores han demostrado que la flora intestinal no es la única fuente de metano endógeno , sino que el gas también aparece, en pequeñas cantidades, durante el proceso de la peroxidación lipídica en las células eucariotas. La producción de metano endógeno también surge durante una hipoxia mitocondrial inducida, por ejemplo, por intoxicación por azida de sodio. Por este motivo se piensa que el metano podría ser una señal intercelular de hipoxia y estrés. También se produce metano durante la sepsis o la endotoxemia bacterial, y también durante una endoxotemia inducida por la administración de un lipopolisacárido.
El metano producido por la flora intestinal, no es totalmente «biológicamente neutral» pues participa en la regulación fisiológica de la peristalsis. En exceso causa eructos, flatulencia, dolor de vientre, y estreñimiento funcional.
Etileno
El etileno sirve como una hormona en las plantas. Interviene durante toda la vida de la planta en la estimulación o regulación de la maduración de los frutos, la formación de las flores, y la abscisión (o caída) de las hojas.
El gas de etileno generado a partir un suplemento líquido de etanol se usa industrialmente para la maduración de frutas en cámaras de almacenamiento, a un nivel entre 500 a 2000 ppm durante uno o dos días. Ya en la Antigüedad se recurría al uso del etileno para estimular la maduración: se sabe que los egipcios cortaban los higos para que maduraran antes; esto ocurre porque el corte estimula la producción de etileno por los tejidos de la planta. Los chinos quemaban incienso en habitaciones cerradas para madurar las peras.
En 1864, se descubrió que las fugas de gas de las farolas frenaban notablemente el crecimiento de las plantas y causaban un engrosamiento anormal de los tallos. En 1901, el científico ruso Dimitri Neljubow demostró que el etileno era el agente activo. Sarah Doubt descubrió que el etileno estimulaba la abscisión en 1917. No fue hasta 1934 que Gane halló que las plantas sintetizaban el etileno. En 1935, Crocker propuso que el etileno era la hormona de las plantas responsable de la maduración de las frutas y de la senescencia de los tejidos vegetales.
El etileno es producido por todas las partes de las plantas superiores: raíces, hojas, tallos, flores, frutas, y semillas. Durante el ciclo vital de la planta, esta genera etileno durante la germinación, la maduración de las frutas, la abscisión de las hojas, y la senescencia de las flores. Existen también factores externos y ambientales que estimulan la producción de etileno, como los daños mecánicos, y la presencia de ciertos compuestos químicos, como la auxina. Las inundaciones, sequías, frío y ataques de patógenos se cuentan entre los factores externos que pueden inducir la formación de etileno. Durante las inundaciones, las raíces sufren de falta de oxígeno, o de anoxia y producen ácido 1-aminociclopropano-1-carboxílico, que se combierte en etileno al oxidarse en las hojas. El etileno producido causa movimientos de nastia de las hojas, tal vez para ayudar a que la planta pierda agua.
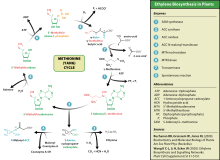
La presencia de etileno exógeno o endógeno induce su biosíntesis, que comienza con la transformación del aminoácido metionina en S-adenosil-L-metionina (SAM, también llamada AdoMet) por la enzima met-adenosiltransferasa. La enzima 1-aminociclopropano-1-carboxilato sintasa (ACS) convierte entonces la SAM en ácido 1-aminociclopropano-1-carboxílico (ACC). La regulación de la ACS es clave para la biosíntesis del etileno. El paso final requiere oxígeno y es catalizado por la enzima aminociclopropanocarboxilato oxidasa (ACO), conocida como EFE (etylene forming enzyme).
Los receptores de etileno forman una familia de varios dímeros proteicos transmembranales. Un ejemplo es la proteína ETR1 en Arabidopsis. Los receptores de etileno son codificados por múltiples genes en Arabidopsis y en el tomate. Las mutaciones de cualquier gen de la familia, formada por cinco receptores en Arabidopsis y al menos seis en el tomate, pueden conducir a la insensibilidad al etileno. Se han identificado las secuencias del ADN para los receptores de etileno en otras especies de plantas y se ha encontrado una proteína que se une con el etileno incluso en cianobacterias.
Los mamíferos producen pequeñas cantidades de etileno endógeno durante la peroxidación lipídica. Una parte del etileno endógeno se oxida a óxido de etileno, que puede alcalinizar el ADN y las proteínas, incluyendo la hemoglobina. La alcalinización de la guanina en el ADN tienen un riesgo cancerógeno intrínseco, y es también un mutágeno.
Respuestas al etileno en las plantas
El etileno en la planta induce las siguientes respuestas:
- Durante la formación de la semilla, produce el engrosamiento y acortamiento del hipocótilo.
- Tras la polinización, causa la caída de los pétalos.
- Estimula la senescencia de las hojas y flores.
- Estimula la senescencia de células maduras de xilema.
- Induce abscisión de las hojas.
- Induce la germinación de semillas.
- Induce el crecimiento de las raíces.
- Induce el crecimiento de raíces adventicias durante las inundaciones.
- Estimula la epinastia, proceso en qel que el pecíolo de la hoja crece, la hoja cuelga y se dobla sobre sí misma.
- Estimula la maduración de las frutas.
- Induce un aumento en la respiración de algunas frutas durante su maduración.
- Afecta al gravitropismo.
- Estimula los giros nutacionales.
- Inhibe el crecimiento del tallo y estimula la ampliación del tallo y el crecimiento de ramas laterales.
- Interfiere con el transporte de las auxinas (en presencia de concentraciones altas de estas hormononas).
- Inhibe el crecimiento del tallo y la clausura del estoma excepto en algunas plantas acuáticas o en plantas que crecen en zonas inundadas como en algunas variedades de arroz.
- Induce el florecimiento en las piñas.
- Inhibe el florecimiento de Pharbitus nil y Chrysanthemum morifolium durante los días cortos.
-
 Datos: Q657925
Datos: Q657925
-
 Multimedia: Gaseous signaling molecules / Q657925
Multimedia: Gaseous signaling molecules / Q657925