Metagenómica
La metagenómica se define como el estudio del material genético, el cual es obtenido directamente de muestras ambientales. Este amplio campo también puede ser conocido como genómica ambiental, ecogenómica o genómica de la comunidad.
Por otro lado, la microbiología tradicional, la secuenciación del genoma microbiano y la genómica están basadas en la clonación. Las primeras secuenciaciones génicas clonaban genes específicos (normalmente el gen del ARNr 16S) para producir un perfil específico de la diversidad en una muestra natural. Dicho trabajo reveló que la gran mayoría de la biodiversidad microbiana se había perdido debido a los métodos basados en el cultivo. Estudios recientes, usando tanto secuenciación escopeta como el método de secuenciación de PCR dirigido para obtener muestras no alteradas de todos los genes de todos los miembros de la comunidad de la muestra tomada. Debido a su habilidad para revelar la vida microscópica previa escondida, la metagenómica ofrece una manera poderosa de poder ver y conocer el mundo microbiano que tiene el potencial de revolucionar el entendimiento de todo el mundo vivo. Como el precio de la secuenciación de ADN sigue cayendo, la metagenómica ahora permite investigar la ecología microbiana a mayor escala y con mejor detalle que antes.
Etimología
El término "metagenómica" fue utilizado por primera vez por, entre otros, Jo Handlesman, Jon Clardly y Robert M. Goodman. Fue en 1998 cuando apareció por primera vez en una publicación científica. El término metagenoma hacía referencia a un abordaje que pretendía analizar una colección de genes secuenciados de una muestra ambiental como si se tratara de un único genoma. Recientemente, Kevin Chen y Lior Pachter (investigadores de la Universidad de California, en Berkeley), definieron la metagenómica como «la aplicación de técnicas genómicas modernas para el estudio directo de comunidades de microorganismos en su entorno natural, evitando la necesidad de aislar y cultivar cada una de las especies que componen la comunidad».
Historia
La secuenciación convencional comienza con un cultivo de células idénticas como fuente de ADN. Sin embargo, los primeros estudios metagenómicos revelaron que hay muchos grupos de microorganismos en diferentes ambientes que no pueden ser cultivados y por lo tanto no pueden ser secuenciados. Estos primeros estudios se concentraban en las secuencias de ARN ribosomal 16S que son relativamente cortas, normalmente conservada dentro de una especie, y generalmente diferente entre especies Muchas secuencias del ARNr 16S que han sido encontradas no corresponden a ninguna especie cultivada, indicando que hay una gran cantidad de organismos que no han sido aislado. Estos estudios de los genes de ARNr que se toman directamente del medio ambiente revelaron que los métodos de cultivos básicos encuentran menos del 1% de las bacterias y arqueas en una muestra. Gran parte del interés en la metagenómica viene de estos descubrimientos, que demostraron que la gran mayoría de los microorganismos han pasado desapercibidos.
Los primeros trabajos moleculares llevados a cabo en el campo fueron dirigidos por Norman R. Pace y sus colegas, quienes usaron PCR para explorar la diversidad de las secuencias de ARN ribosomal. La percepción que se obtuvo a partir de estos estudios tan avanzados condujeron a Pace a proponer la idea de clonar ADN directamente de muestras del medio ambiente a principios de 1985. Esto condujo al primer reporte de aislamiento y clonación ADN desde muestras ambientales, publicado por Pace y sus colegas en 1991, cuando Pace estaba en el Departamento de Biología en la Universidad de Indiana. Considerables esfuerzos aseguraron que no se tratase de falsos positivos del PCR y apoyaron la existencia de una comunidad compleja e inexplorada de especies. Aunque esta metodología estaba limitada a explorar genes no codificadores para proteínas que se conservan bastante, también ayudó a realizar las primeras observaciones microbianas basadas en la morfología demostrando que la diversidad era mucho más compleja que la conocida por los métodos de cultivo. Poco después de eso Healy reportó el aislamiento metagenómico de genes funcionales de "zoolibraries" construidas a partir de un cultivo complejo de organismos ambientales crecidos en un laboratorio en hierbas secas en 1995. Tras dejar el laboratorio de Pace, Edward DeLong continuó en el campo y ha publicado trabajos que básicamente ha fijado las bases de trabajo para ofilogenias ambientales basado en la firma de secuencias 16S, empezando con la construcción de bibliotecas de muestras marinas por parte de su equipo.
En 2002, Mya Breitbart, Forest Rohwer y sus colegas utilizaron la secuenciación de escopeta (ver abajo) para el ambiente para mostrar que 200 litros de agua de mar contienen más de 5000 virus diferentes. Estudios subsiguientes demostraron que hay más de mil especies virales en las heces humanas y posiblemente un millón de virus diferentes por kilogramo de sedimento marino, incluyendo bacteriófagos. Básicamente todos los virus en estos estudios eran especies nuevas. En 2004, Gene Tyson, Jill Banfield, y sus colegas en University of California, Berkeley y el Joint Genome Institute secuenciaron el ADN extraído de un sistema de drenaje de minas de ácidos Este esfuerzo resultó en los genomas completos o casi completos de un grupo de bacterias y arqueas que habían resistido intentos previos para ser cultivados.
Empezando en el 2003, Craig Venter, líder del proyecto fundado de manera privada y paralelo al Proyecto del Genoma Humano, dirigió la Expedición Global Oceánica de Muestras (GOS), circunnavegando el globo y recolectando muestras metagenómicas durante todo el viaje. Todas estas muestras se secuenciaron usando secuenciación de escopeta, con la esperanza de que fueran identificados nuevos genomas (y por lo tanto nuevos organismos). El proyecto piloto, que se llevó a cabo en el mar de los Sargazos, encontró ADN de casi 2000 especies diferentes, incluyendo 148 tipos de bacterias nunca vistas anteriormente. Venter ha circunnavegado el globo y explorado a fondo la costa Oeste de Estados Unidos, completó una expedición de dos años para explorar el mar Báltico, el mar Mediterráneo y el mar Negro. Los análisis de la información metagenómica recopilada durante dicho viaje revelaron dos grupos de organismos, uno compuesto de taxones adaptado para condiciones ambientales 'feast or famine', y un segundo compuesto de relativamente menos, pero más abundantes y mejor distribuidos taxones, compuestos principalmente de plankton.
En el 2005 Stephan C. Schuster en Penn State University y sus colegas publicaron las primeras secuencias de una muestra ambiental generada mediante secuenciación de alto rendimiento, en este caso pirosecuenciación masiva y paralela desarrollada por 454 Life Sciences. Otro trabajo que apareció a principios de estos estudios fue de Robert Edwards, Forest Rohwer, y sus colegas en el 2006 en San Diego State University.
Secuenciación
La recuperación de secuencias de ADN mayores de unos pocas miles de pares de bases era muy difícil hasta la reciente llegada de avanzadas técnicas de biología molecular que permiten la construcción de genotecas de cromosomas artificiales bacterianos (BACs), que poseen numerosas ventajas como vectores, no presentes en los vectores de clonación disponibles hasta su aparición.

Secuenciación
El poder recuperar secuencias de ADN más largas de unos cuantos miles pares de bases de muestras ambientales fue bastante difícil hasta avances recientes en las técnicas de biología molecular que permitieron la construcción de bibliotecas en cromosomas artificiales de bacteria, las cuales proporcionaban mejores vectores de la clonación molecular.
Metagenómica de escopeta
Los avances en bioinformática, el refinamiento de las amplificaciones de ADN y la proliferación de poder computacional han ayudado significativamente al análisis de las secuencias de ADN recuperadas de muestras ambientales, permitiendo la adaptación de la secuenciación de escopeta a las muestras metagenómicas. La manera, que se usa para secuenciar muchos microorganismos cultivados y el genoma humano, es cortar aleatoriamente el ADN en muchas secuencias cortas y reconstruirlas en una secuencia de consenso. La secuenciación de escopeta revela los genes presentes en las muestras ambientales. Antes las bibliotecas de clonación se utilizaban para facilitar la secuenciación. Sin embargo, con los avances en las tecnologías de secuenciación de alto rendimiento la clonación ya no es necesaria y es posible obtener un mejor porcentaje de la información secuenciada prescindiendo de este paso, que es largo y tedioso. La metagenómica de escopeta proporciona información acerca de qué organismos están presentes y qué procesos metabólicos son posibles en la comunidad. Como el conjunto de ADN de un ambiente es poco controlado, los organismos más abundantes en una muestra ambiental están representados mejor en los resultados de la secuenciación de información. Para lograr la mayor cobertura requerida para obtener los genomas de los miembros de comunidades poco representadas, a veces se usan muestras grandes, normalmente excesivamente costosas. Por otro lado, la naturaleza de aleatoriedad de la secuenciación de escopeta asegura que muchos de estos organismos, que de otra manera pasarían desapercibidos al utilizarse técnicas tradicionales de cultivo, serán representados por lo menos por algunos segmentos pequeños de la secuencia.
Secuenciación de alto rendimiento
Los primeros estudios metagenómicos que se llevaron a cabo con la secuenciación de alto rendimiento usaron de manera paralela 454 pyrosequencing. Otras tres tecnologías comúnmente utilizadas para el muestreo ambiental son Ion Torrent Personal Genome Machine, Illumina MiSeq o HiSeq y Applied Biosystems SOLiD. Estas técnicas para la secuenciación de ADN generan fragmentos más cortos que la secuenciación de Sanger; Ion Torrent PGM System y 454 pyrosequencing normalmente producen lecturas de ~400 pares de bases, Illumina MiSeq produce lecturas de 400-700 pares de bases (dependiendo de si se usan las opciones de pareo de los extremos), y Applied Biosystems SOLiD produce lecturas de 25-75 pares de bases Históricamente, estas longitudes de lecturas eran un poco más cortas de lo que lee la secuenciación de Sanger de ~750 pares de bases, pero la tecnología Illumina se está acercando rápidamente a este punto de referencia. No obstante, esta limitación es compensada por el mucho mayor número de secuencias leídas. En 2009, la pirosecuenciación de metagenomas generaba 200–500 megabases, y las plataformas de Illumina generaban alrededor 20–50 gigabases, pero estos resultados han aumentado en magnitudes considerables en los últimos años. Una ventaja adicional de la secuenciación de alto rendimiento es que esta técnica no requiere clonar el ADN antes de secuenciar, evitando así uno de los procesos más largos y complicados del muestreo ambiental.
Bioinformática
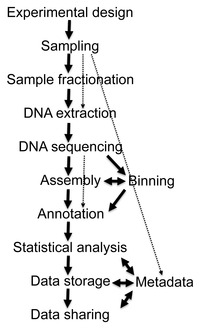
La información generada por los experimento de la metagenómica es mucha e inheremente ruidosa, conteniendo información fragmentada que representa a más de 10,000 especies. La secuenciación del genoma de la vaca rumiante generó 9 gigabases, o 279 mil millones pares de bases de nucleótidos secuenciados, mientras que el catálogo de genes del microbioma del intestino humano identificó 3.3 mil millones de genes ensamblados de 567.7 gigabases información secuenciada. La recogida, el tratamiento y la extracción de información biológica útil a partir de conjuntos de datos de este tamaño suponen importantes desafíos computacionales para los investigadores.
Secuencia pre-filtrada
El primer paso del análisis de información metagenómica requiere la ejecución de ciertos pasos de pre-filtrado, incluyendo el quitar secuencias redundantes de baja calidad y secuencias de origen eucarionte (especialmente en metagenomas de origen humano). Los métodos disponibles para quitar secuencias genómicas de ADN contaminantes y eucarióticas incluyen Eu-Detect y DeConseq.
Ensamblaje
La información de secuencias de ADN de proyectos genómicos y metagenómicos son básicamente lo mismo, pero las secuencias genómicas ofrecen mayor cobertura mientras que la información metagenómica es normalmente muy no-redundante. Así mismo, el incremento en el uso de tecnologías de segunda generación con longitudes de lectura cortas significa que una gran parte de la información metagenómica futura será propensa a errores. Combinando estos factores, hacen el ensamblaje de las lecturas de secuencias metagenómicas a genomas difíciles y poco confiables. Los ensamblajes mal hechos son ocasionados por la presencia de secuencias repetitivas del ADN que vuelven el ensamblaje especialmente difícil por la diferencia en la cantidad relativa de especies presentes en la muestra. Los ensamblajes mal hechos también pueden incluir la combinación de secuencias de más de una especie a cóntigos quiméricos.
Existen programas de ensamblaje, la mayoría de los cuales pueden usar la información de las etiquetas pareadas al final con el propósito de mejorar la precisión de los ensamblajes. Algunos programas, como Phrap o Celera Assembler, fueron diseñados para ensamblar genomas sencillos, pero generan buenos resultados al ensamblar información de conjuntos metagenómicos. Otros programas, como Velvet assembler, han sido optimizados para las lecturas más cortas producidas por la secuenciación de segunda generación a través del uso de de Bruijn graphs. El uso de genomas de referencia permite a los investigadores mejorar el ensamblaje de las especies microbiales más abundantes, pero este acercamiento está limitado por el pequeño subconjunto de filos para los cuales hay genomas secuenciados disponibles. Después de que se haga un ensamblaje, otro reto es "la deconvolución metagenómica", o determinar que secuencias vienen de que especies en la muestra.
Predicción de genes
Los análisis metagénomicos de las fuentes de información utilixan dos acercamientos en la anotación de regiones codificantes en los cóntigos ensamblados. El primer acercamiento es identificar los genes basándose en la homología con genes que ya estén públicamente disponibles en las bases de datos de secuencia, normalmente por simples búsquedas BLAST. Este tipo de acercamiento está implementado en el programa MEGAN4. El segundo, ab initio, utiliza características intrínsecas de la secuencia para predecir las regiones codificantes basándose en conjuntos de genes de organismos relacionados. Este es el acercamiento tomado por programas comoGeneMark y GLIMMER. La ventaja principal de la predicción ab initio es que permite la detección de regiones codificantes que no tengan homólogos en las bases de datos de secuencias, pero resulta más preciso cuando hay grandes regiones continuas de ADN genómico para comparación.
Diversidad de especies
La anotación de genes proporciona el "que", mientras que las mediciones de la diversidad de especies proporcionan el "quien" . Para poder conectar la función y la composición de la comunidad en metagenomas, las secuencias deben estar agrupadas. El agrupamiento es el proceso de asociar una secuencia en partículas con un organismo. En métodos de agrupamiento por similitud como BLAST se usan para buscar rápidamente marcadores filogenéticos o de otro modo secuencias similares en las bases de datos públicas existentes. Este acercamiento es implementado en MEGAN. Otra herramienta, PhymmBL, utiliza modelos interpolados de Markov para asignar lecturas. MetaPhlAn y AMPHORA son métodos basados en marcadores de clados específicos para estimar la abundancia relativa con desempeños computacionales mejorados. Una vez que las secuencias son agrupadas, es posible llevar a cambo análisis comparativos de la diversidad y la riqueza utilizando herramientas como Unifrac.
Integración de la información
La cantidad masiva de información se secuenciación que no deja de crecer exponencialmente es un reto desalentador que se complica por la complejidad de la metadata asociada con proyectos metagenómicos. La Metadata incluye información detallada acerca de la geografía tridimensional y las características ambientales de la muestra, información física acerca del sitio de la muestra y la metodología del muestreo. Dicha información es necesaria tanto para asegurar la replicabilidad como para permitir el análisis downstream.
Se han desarrollado varias herramientas para integrar la metadata y la información de secuencias, permitiendo un análisis comparativo downstream de diferentes conjuntos de información mediante un número de índices ecológicos. En 2007, Folker Meyer y Robert Edwards y un equipo en Argonne National Laboratory en University of Chicago liberó el Metagenomics Rapid Annotation usando el servidor de Subsystem Technology (MG-RAST), un recurso comunitario para los análisis de conjuntos de metgagenomas. Desde junio del 2012, han sido analizadas más de 14.8 terabases (14x1012 bases) de ADN, con más de 10,000 conjuntos de información pública disponible dentro de MG-RAST. Más de 8,000 usuarios han presentado un total de 50,000 metagenomas a MG-RAST. El sistema Integrated Microbial Genomes/Metagenomes (IMG/M) también proporciona una serie de herramientas para el análisis funcional de comunidades microbianas basado en su secuencia de metagenoma, basado en aislamiento de genomas como referencia incluida del sistema Integrated Microbial Genomes (IMG) y del proyecto Genomic Encyclopedia of Bacteria and Archaea (GEBA).
Una de las primeras y en aquel entonces única herramienta para analizar un metagenoma por alto rendimiento de información obtenida de escopeta fue MEGAN (MEta Genome ANalyzer). Una primera versión del programa fue usada en 2005 para analizar el contexto metagenómicos de secuencias de ADN obtenidas de un hueso de mamut. Basado en una comparación en BLAST contra una base de datos de referencia, esta herramienta llevó a cabo tanto el reagrupamiento taxonómico como el funcional, al colocar las lecturas en los nodos de la taxonomía NCBI usando un simple algoritmo de ancestro menos común o en los nodos de SEED o KEGG.
Metagenómica comparativa
Los análisis comparativos entre metagenomas pueden proporcionar una percepción adicional hacia la función de comunidades microbianas complejas y su papel en la salud del huésped. Una comparación múltiple entre metagenomas puede hacerse a un nivel de la composición de la secuencia (comparando contenido GC o tamaño del genoma) taxonomía, diversidad o complemento funcional. Las comparaciones de las estructuras poblacionales y la diversidad filogenética pueden hacerse en la base de 16S y otros marcadores filogenéticos, o —en el caso de comunidades poco diversas— por reconstrucción de genoma del conjunto de información metagenómica. Las comparaciones funcionales entre metagenomas pueden hacerse al comparar secuencias contra las referencias en las bases de datos como COG o KEGG, y tabulando la abundancia por categoría y evaluando cualquier diferencia por significación estadística. Este acercamiento centrado en genes enfatiza el complemento funcional de la comunidad como uno, y no como grupos taxonómicos y demuestra que los complementos funcionales son análogos bajo condiciones ambientales similares. Por consiguiente, la metadata en un contexto ambiental de las muestras metagenómicas es especialmente importante en análisis comparativos, ya que proporciona a los investigadores la habilidad de estudiar el efecto del hábitat sobre la estructura de la comunidad y la función.
Además, varios estudios también han utilizado patrones de uso de oligonucleótidos para identificar las diferencias a través de diversas comunidades microbianas. Ejemplos de dichas metodologías incluyen el acercamiento de Willnet et al, la abundancia relativa del dinucleótido. y el acercamiento de HabiSign por Ghosh et al. Ghosh et al. (2011) también indicó que diferencias en los patrones de uso pueden ser usadas para identificar genes (o lecturas metagenómicas) originándose en hábitats específicos. Además algunos métodos como TriageTools o Compareads detectan lecturas similares entre dos conjuntos de lecturas. La medida de similitud que aplican en las lecturas se basa en el número de palabras idénticas de longitud k compartido por pares de las lecturas.
Un objetivo clave en la metagenómica comparativa es poder identificar grupos microbianos que son responsables de otorgar características específicas a cierto ecosistema. Sin embargo, debido a problemas con las tecnologías de secuenciación de los artefactos deben considerarse como si fuera metagenomeSeq. Otros han caracterizado interacciones inter-microbianas entre los grupos microbianos residentes.. Una aplicación de análisis comparativo metagenómicos basado en GUI llamada Community-Analyzer ha sido desarrollada por Kuntal et al. , que implementa una gráfica basada en una correlación y despliega un algoritmo que no solo facilita una visualización rápida de las diferencias en las comunidades microbianas analizadas (en términos de composición taxonómica), pero también proporciona una visión hacia las interacciones inherentes inter-microbianas que ocurren ahí. Notablemente, este algoritmo desplegado también permite la agrupación de los metagenomas basándose en los patrones inter-microbianos probables más que por simplemente comparar valores de abundancias de varios grupos taxonómicos. Además, la herramienta implementa diversas funcionalidades interactivas basadas en GUI que permiten a los usuarios realizar un análisis comparativo estándar a través de microbiomas..
Análisis de datos
Metabolismo de la comunidad
En muchas comunidades bacterianas, naturales o diseñadas (como bioreactores), hay una división significativa de trabajo en el metabolismo (sintropía), durante la cual los desechos de algunos organismos son metabolitos de otros. En dicho sistema, la estabilidad funcional del bioreactor metanogénico requiere la presencia de varias especies sintrópicas. (Syntrophobacterales y Synergistia) trabajando juntas para poder convertir recursos crudos en residuos metabolizados completamente (metano). Usando estudios de comparación de genes y experimento de expresión con microarreglos o investigadores de proteómica pueden crear una red metabólica que vaya más allá de las fronteras de las especies. Dicho estudio requiere un conocimiento detallado acerca de qué versiones de qué proteínas son codificadas por qué especies e, incluso, por qué tipos de qué especies. Por lo tanto, la información de la genómica de comunidad es otra herramienta fundamental (junto con la metabolómica y la proteómica) en la búsqueda para determinar cómo los metabolitos son transferidos y transformados por una comunidad.
Metatranscriptómica
La metagenómica permite a los investigadores acceder la diversidad funcional y metabólica de comunidades microbianas, pero no puede demostrar cual de estos procesos está activo. La extracción y los análisis del ARNm metagenómico (el metatranscriptoma) proporciona información sobre la regulación y perfiles de expresión de comunidades complejas. Debido a las dificultades técnicas (la corta vida media del ARNm, por ejemplo) presentes en la recolección de ARN ambiental, ha habido relativamente pocos estudios metatranscriptómicos in situ de las comunidades microbianas hasta la fecha. Mientras que originalmente estaban limitados a la tecnología de microarreglos, los estudios metatranscriptómicos han usado directamente secuenciación de alto rendimiento del ADNc para proporcionar la expresión del genoma completa y cuantificación de una comunidad microbiana, primero empleada por Leininger et al. (2006) en su análisis de oxidación de amoniaco en suelos.
Virus
La secuenciación metagenómica resulta particularmente útil en el estudio de comunidades virales. Como los virus no tienen un marcador filogenético universal que compartan (como el ARN 16S para bacterias y arquea y el ARN 18S para eucariota), la única manera de acceder a la diversidad genética de la comunidad viral desde una muestra ambiental es a través de la metagenómica. La metagenómica viral debe poder proporcionar más y más información acerca de la diversidad viral y la evolución. Por ejemplo, una fuente de información metagenómica llamada Giant Virus Finder aportó la primera evidencia de la existencia de virus gigantes en un desierto salino.
Aplicaciones
La metagenómica tiene el potencial de avanzar el conocimiento en una gran variedad de campos. También puede aplicarse a la resolución de retos prácticos en medicina, ingeniería, agricultura, sostenibilidad y ecología.
Medicina
Las comunidades microbianas juegan un papel clave en la preservación de la salud humana, pero su composición y el mecanismo por el que hacen esto sigue siendo un misterio. La secuenciación metagenómica está siendo usada para caracterizar las comunidades microbianas de 15-18 sitios del cuerpo de por lo menos 250 individuos. Esto es parte de la Iniciativa del Microbioma Humano, con los objetivos principales de determinar si existe un microbioma humano central, entender los cambios en el microbioma humano que pueden correlacionarse con la salud humana y desarrollar nuevas herramientas tecnológicas y de bioinformática para poder alcanzar dichos objetivos.
Otro estudio médico parte del proyecto MetaHit (Metagenómica de Tracto Intestinal Humano) consistió de 124 individuos de Dinamarca y España saludables, con sobrepeso y pacientes con síndrome del intestino irritable. El estudio intentó categorizar la profundidad y la diversidad filogenética de las bacterias gastrointestinales. Utilizando datos de secuenciación de Illumina GA y SOAPdenovo, de Bruijn, una herramienta basada en gráficas diseñada específicamente para ensamblar lecturas cortas, fueron capaces de generar 6.59 millones de cóntigos mayores a 500 pares de bases para un cóntigo de longitud total de 10.3 Gb y un N50 de 2.2 kb.
El estudio demostró que dos divisiones bacterianas, Bacteroidetes y Firmicutes, constituyen más del 90% de las categorías filogenéticas que dominan la bacteria intestinal. Usando las frecuencias relativas de los genes encontrados dentro del intestino, estos investigadores encontraron 1,244 agrupaciones metagenómicas que son críticamente importantes para la salud del tracto intestinal. Hay dos tipos de funciones en estas agrupaciones: gestión interna y las que son específicas para el intestino. Las agrupaciones de genes de gestión interna son necesarias en todas las bacterias y normalmente son componentes clave en los principales mecanismos metabólicos incluyendo el metabolismo central del carbono y la síntesis de aminoácidos. Las funciones específicas del intestino incluyen adhesión a proteínas huéspedes y la cosecha de azúcares a partir de los glicolípidos globoseries. Pacientes con el síndrome del intestino irritable exhibieron un 25% menos de genes y menor diversidad bacteriana que los individuos que no sufrían de la enfermedad, indicando que cambios en la diversidad de la bioma intestinal del paciente pueden estar asociados con esta condición.
Mientras estos estudio destacan algunas aplicaciones potenciales médicas importantes, solo 31-48.8% de las lecturas puede alinearse a 194 genomas públicos del intestino humano y 7.6-21.2% a los genomas de las bacterias disponibles en GenBank, lo cual indica que hace falta mucha más investigación para capturar los genomas bacterianos necesarios.
Biocombustibles

Los biocombustibles son combustibles derivados de la conversión de biomasa, como en la conversión de celulosa contenida en tallos de maíza y otra biomasa en etanol celúlosico Este proceso depende de los consorcios microbianos que transforman la celulosa en azúcares, seguido de la fermentación de los azúcares para formar etanol. Los microbios ambientan producen una variedad de fuentes de bioenergía incluyendo metano e hidrógeno.
La deconstrucción eficiente a escala industrial de biomasa requiere enzimas nuevas con mayor productividad y menor costo. Los acercamientos metagenómicos al análisis de comunidades microbianas complejas permite la proyección de enzimas con aplicaciones industriales para la producción de biocombustibles como las hidrolasas glicosídicas. Además se require conocimiento de como la función de estas comunidades microbianas se requiere para controlaras y la metagenómica es la herramienta clave para entenderlas. Los acercamientos metagenómicos permiten análisis comparativos entre sistemas microbianos convergentes como fermentadores de biogás o insectos herbívoros como el hongo del jardín de las hormigas cortahojas.
Remediación Ambiental
La metagenómica puede mejorar las estrategias para monitorear el impacto de contaminantes en los ecosistemas y para limpiar los ambientes contaminados, un mejor entendimiento de como las comunidades microbianas se enfrentan con los contaminantes mejora las evaluaciones de los sitios potencialmente contaminados para recuperarlos e incrementar las oportunidades de los ensayo de bioaumentación y bioestimulación funcionen.
Biotecnología
Las comunidades microbianas producen un arreglo de químicos biológicos activos que son usados en competencia y comunicación. Muchos de los fármacos usados hoy en día fueron originalmente descubiertos en microbios; el progresos reciente explotando los ricos recursos genéticos de microbios no cultivables ha dirigido al descubrimiento de nuevos genes, enzimas y productos naturales. La aplicación de la metagenómica ha permitido el desarrollo de productos, químicos finos y farmacéuticos donde el beneficio de la síntesis quiral de enzima catalizada es ampliamente reconocido.
Dos tipos de análisis son usados en la bioprospección de la información metagenómica: la proyección impulsada por una función para una característica expresada y proyección impulsada en una secuencia para secuencias de ADN de interés. Los análisis impulsados en una función buscan identificar clones expresando una característica deseada o una actividad útil, seguido por caracterización bioquímica y análisis de secuencia. Este acercamiento está limitado por la disponibilidad de una pantalla adecuada y el requisito de que la característica deseada debe estar expresada en la célula huésped. Además, el bajo rango de descubrimiento (menos de uno por cada 1,000 clones proyectados) y la intensa carga de trabajo que requiere limitan el acercamiento. En contraste, los análisis impulsados por secuencia usan secuencias conservativas de ADN para diseñar los primers para PCR para proyectar clones para la secuencia de interés. En comparación a los acercamientos basados en clonación, usar un acercamiento solo basado en la secuencia reduce la cantidad de exhibición requerida. La aplicación de secuenciación masiva paralela también aumenta de manera importante la cantidad de información de secuenciación generado, la cual requiere fuentes de análisis bioinformático de alto rendimiento. El acercamiento impulsado por secuencia para proyectar está limitado por la amplitud y la precisión de las funciones de los genes presentes en bases de datos de secuencias públicas. En la práctica, en los experimentos se hace uso de una combinación de ambos acercamiento basados en la función de interés, la complejidad de la muestra a proyectarse y otros factores.
Agricultura
Los suelos donde crecen las plantas están habitados por comunidades microbianas con un gramo de suelo conteniendo alrededor de 109-1010 células microbianas que comprenden cerca de una gigabase de información de secuencia. Las comunidades microbianas que habitan suelos son de las más complejas conocidas por la ciencia, y permanecen poco entendidas a pesar de su importancia económica. Los consorcios microbianos realizan una variedad de servicios ecológicos necesarios para el crecimiento de plantas, incluyendo fijar el nitrógeno de la atmósfera, el ciclo de nutrientes, supresión de enfermedades y secuestro de hierro y otro metales. Las estrategias funcionales metagenómicas están siendo usadas en explorar la interacción entre plantas y microbios a través del cultivo independiente de las comunidades microbianas. Al permitir una percepción de los papeles de miembros de la comunidad no cultivados en el ciclo de los nutrientes y la promoción del crecimiento de las plantas, los acercamientos metagenómicos puede contribuir a una mejor detección de enfermedades en cosechas y ganado y la adaptación de mejores prácticas agrícolas que mejoren la salud de las cosechas al aprovechar la relación entre los microbios y las plantas.
Ecología
La metagenómica puede proporcionar una percepción muy importante hacia la ecología funcional las comunidades ambientales. Los análisis metagenómicos del consorcio de bacterias encontrados en la defecación de los leones marinos australianos sugiere que las heces ricas en nutrientes de los leones marinos pueden ser un nutriente importante para ecosistemas costeros. Esto es porque las bacterias que son expulsadas simultáneamente con las heces son ideales para descomponer los nutrientes en las heces en una forma biodisponible que puede ser tomada en la cadena alimenticia.
La secuenciación del ADN también puede ser usada de manera más amplia para identificar especies presentes en un cuerpo de agua, los escombros filtrados del aire o una muestra de tierra. Esto puede establecer el rango de especies invasoras y especies en peligro al igual que rastrear poblaciones de temporada.
Véase también
Enlaces externos
- Focus on Metagenomics at Nature Reviews Microbiology journal website
- The “Critical Assessment of Metagenome Interpretation” (CAMI) initiative to evaluate methods in metagenomics
- Metagenomics Sequencing for microscopic life Research
-
 Datos: Q903778
Datos: Q903778
-
 Multimedia: Metagenomics / Q903778
Multimedia: Metagenomics / Q903778