Ixazomib
| Ixazomib | ||
|---|---|---|
| ||
| Nombre (IUPAC) sistemático | ||
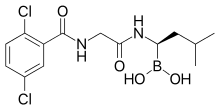
| Ácido [(1R)-1-[(2-[(2,5-diclorobenzoil)amino)acetil]amino]-3-metilbutil]boronico | ||
| Identificadores | ||
| Número CAS | 1072833-77-2 | |
| Código ATC | L01XX50 | |
| PubChem | 25183872 | |
| DrugBank | DB09570 | |
| Datos químicos | ||
| Fórmula | C14H19N2Cl2O4B | |
| Peso mol. | 361.03 g·mol−1 | |
|
B(C(CC(C)C)NC(=O)CNC(=O)C1=C(C=CC(=C1)Cl)Cl)(O)O
| ||
| Datos clínicos | ||
| Estado legal | Autorizado (UE, EUA) | |
| Vías de adm. | Vía oral | |
Ixazomib (nombre comercial Ninlaro) es un medicamento para el tratamiento del mieloma múltiple, un tipo de cáncer de célula blanca de la sangre, en combinación con otros fármacos. Se toma por vía oral en forma de cápsulas.
Los efectos secundarios comunes incluyen diarrea, estreñimiento y recuento bajo de plaquetas . Al igual que el bortezomib (que solo puede ser administrado por inyección), actúa como un inhibidor del proteasoma, tienes status Medicamento huérfano en los Estados Unidos y Europa, y es un derivado del ácido borónico.
El fármaco fue desarrollado por Takeda. En los Estados Unidos, está aprobado desde noviembre de 2015, y en la UE a partir de noviembre de 2016.
Usos médicos
El Ixazomib es utilizado en combinación con Lenalidomida y Dexametasona para el tratamiento del mieloma múltiple en adultos tras el uso de al menos una terapia previa. No hay ninguna experiencia con niños y jóvenes menores de 18 años de edad.
El estudio pertinente para su aprobación incluyó 722 personas. En este estudio, ixazomib aumentó el tiempo medio de supervivencia libre de progresión de 14,7 meses (en la rama del placebo+lenalidomida+dexametasona se incluyeron 362 personas) a 20.6 meses (en la rama de ixazomib+lenalidomida+dexametasona se incluyeron 360 personas), lo que le dio un efecto estadísticamente significativo (p = 0.012). El 11,7% de los pacientes en el grupo de ixazomib tuvo una respuesta completa al tratamiento, frente a 6,6% en el grupo placebo. La tasa de respuesta global (completa más la parcial) fue de 78,3% frente a un 71,5%.
Embarazo y lactancia
Ixazomib y lenalidomida son teratogénicos en estudios con animales. Este último está contraindicado en mujeres embarazadas, haciendo de este régimen de tratamiento inadecuado para este grupo. No se sabe si ixazomib o sus metabolitos pasan a la leche materna.
Efectos secundarios
Los efectos secundarios más comunes del estudio con la combinación de ixazomib+lenalidomida+dexametasona fueron diarrea (42% frente a un 36% en el placebo+lenalidomida+dexametasona), estreñimiento (34% versus 25%), trombocitopenia (recuento bajo de Plaquetas ; 28% frente a 14%), neuropatía periférica (28% versus 21%), náuseas (26% frente a 21%), edema periférico (hinchazón; 25% frente a 18%), vómitos (22% frente a 11%), y el dolor de espalda (21% frente a 16%). Grave de la diarrea o la trombocitopenia se produjo en el 2% de los pacientes, respectivamente.
Los efectos secundarios de ixazomib solo se evaluaron solo en un pequeño número de personas. La diarrea grado 2 o superior se encuentra en el 24% de estos pacientes, trombocitopenia de grado 3 o superior en 28%, y Cansancio de grado 2 o superior en 26%.
Interacciones
El medicamento tiene bajo potencial de interacciones a través de las enzimas hepáticas Citocromo P450 (CYP) y de las proteínas transportadoras. La única conclusión pertinente en los estudios fue la una reducción de los niveles de ixazomib en la sangre cuando se combina con el potente inductor de la CYP3A4 rifampicina. El Cmax se redujo en un 54% y el área bajo la curva en un 74% en este estudio.
Farmacología
Mecanismo de acción
A concentraciones terapéuticas, ixazomib inhibe de forma selectiva y reversible la proteína del proteasoma de la subunidad beta de tipo 5 (PSMB5) con una disociación de la vida media de 18 minutos. Este mecanismo es el mismo del bortezomib, que tiene mucho más de disociación de la vida media de 110 minutos; el medicamento relacionado carfilzomib, por el contrario, bloquea al PSMB5 de forma irreversible. Las subunidades del proteasoma beta tipo-1 y tipo-2 solo se inhibe en altas concentraciones alcanzadas en los modelos de cultivo celular.
PSMB5 es parte del complejo 20S del proteasoma y tiene actividad enzimática similar a la Quimotripsina. También induce apoptosis, un tipo de muerte celular programada, en varias líneas celulares del cáncer. Un efecto sinérgico de ixazomib y lenalidomide ha sido encontrado en un número grande de líneas de célula del mieloma.
Pharmacocinética
El medicamento se toma por vía oral, como un profármaco, citrato de ixazomib, que es un éster borónico; este éster rápidamente se hidroliza en condiciones fisiológicas a su forma biológicamente activa, ixazomib, un ácido borónico. La biodisponibilidad absoluta es del 58%, y concentraciones plasmáticas más elevadas se logran tras una hora. Su unión a proteínas plasmáticas es del 99%.
La sustancia se metaboliza por muchas de las enzimas del CYP (porcentajes in vitro, más elevadas que las concentraciones clínicas: CYP3A4, el 42.3%, CYP1A2 26.1%, CYP2B6 16.0%, CYP2C8 6.0%, CYP2D6 4.8%, CYP2C9 4.8%, CYP2C9 <1%) así como otras enzimas no pertenecientes al CYP, lo cual podría explicar el bajo potencial de interacción. El aclaramiento es de aproximadamente 1.86 litros por hora, con una amplia variabilidad de 44% entre los individuos, y la vida media en plasma es de 9,5 días. El 62% del ixazomib y sus metabolitos se excretan a través de la orina (de los cuales menos de 3.5% sin modificaciones) y el 22% a través de las heces.
Química
El Ixazomib es un análogo de boronic ácido y péptido como su predecesor el bortezomib. Contiene un derivado del aminoácido leucina con el grupo de ácido carboxílico reemplazado por ácido borónico; y el resto de la molécula ha sido comparado a phenylalanine. La estructura fue descubierto tras el tamizaje a gran escala de las moléculas que contienen boro.
Historia
El fármaco fue desarrollado por Takeda. Obtuvo status de medicamento huérfano en los EE.UU y Europa para el mieloma múltiple en el 2011, y para la amiloidosis AL, en el 2012. Takeda solicitó a los EE.UU. una solicitud para su aprobación en mieloma múltiple en julio del 2015. En septiembre de 2015, la Administración de Alimentos y Medicamentos (FDA) ha concedido a ixazomib en combinación con lenalidomida y dexametasona una prioridad revisión de la designación para el mieloma múltiple. el 20 De noviembre de 2015, la FDA aprobó esta combinación para el tratamiento de segunda línea.
La solicitud de autorización de comercialización en Europa fue rechazado inicialmente por la Agencia Europea de Medicamentos (EMA) en mayo de 2016, debido a la insuficiencia de los datos que muestran un beneficio del tratamiento. Después de una nueva solicitud de reconsideración por Takeda, la EMA concedido una autorización de comercialización el 21 de noviembre de 2016 con la condición de que más estudios de eficacia se llevarse a cabo. La aprobación de la indicación es la misma que en los Estados Unidos.
Investigación
A fecha de enero 2017, ixazomib se encuentra también en Fase III de ensayos clínicos para el tratamiento de AL amiloidosis y plasmacitoma de los huesos, y en fase I/II para otras condiciones.
| Control de autoridades |
|
|---|
-
 Datos: Q20948663
Datos: Q20948663

