
Favipiravir
| Favipiravir | ||
|---|---|---|
| ||
| Nombre (IUPAC) sistemático | ||
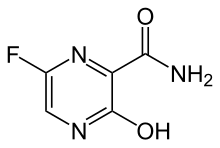
| 5-Fluoro-2-oxo-1H-pyrazine-3-carboxamide | ||
| Identificadores | ||
| Número CAS | 259793-96-9 | |
| Código ATC | No adjudicado | |
| PubChem | 492405 | |
| Datos químicos | ||
| Fórmula | C5H4N3FO2 | |
| Peso mol. | 157.10 g mol−1 | |
| Datos clínicos | ||
| Estado legal | Se encuentra en fase experimental. | |
Favipiravir, también conocido como T-705, es una sustancia química que se emplea experimentalmente como medicamento antivírico contra diferentes tipos de virus ARN. Es un derivado de la pirazinamida, un antibiótico usado en tratamiento de la tuberculosis, que se ha mostrado activo contra el virus de la influenza, el virus de la fiebre amarilla, el virus del Nilo Occidental y otros Flavivirus, Arenavirus, Bunyavirus y Alphavirus. Se ha empleado experimentalmente para tratar la infección por el virus Ébola en humanos, tras mostrarse eficaz en un estudio con ratones de laboratorio.
Mecanismo de acción
Favipiravir actúa inhibiendo la acción de la enzima RNA polimerasa, esencial para la replicación del virus. Favipiravir se convierte en ribofuranosil-trifosfato por enzimas celulares, esta sustancia inhibe de forma selectiva la RNA polimerasa de los virus ARN, sin producir toxicidad aparentemente sobre las células de mamífero ni inhibir en ellas la síntesis de DNA ni RNA celular. No obstante se desconoce en detalle su seguridad y eficacia en humanos por encontrarse aún en fase experimental. La provincia de Santa Fe no ha permitido que se experimente en la región. China ha concluido la investigación clínica del medicamento antiviral Favipiravir, que ha mostrado su eficacia contra el Coronavirus Covid-19, tal y como ha confirmado el Gobierno del país y recoge la agencia de noticias Xinhua. Este fármaco fue aprobado para su uso clínico en Japón en 2014[cita requerida].
Investigación
COVID-19
Favipiravir fue aprobado para uso médico en Rusia. El 30 de mayo de 2020, el Ministerio de Salud de Rusia aprobó una versión genérica de favipiravir llamada Avifavir. En febrero de 2020, se estaba estudiando favipiravir en China para el tratamiento experimental del emergente COVID-19. También se están planificando ensayos en Japón.
Un estudio en 80 personas en comparación con lopinavir / ritonavir encontró que reducía el tiempo de eliminación viral y que el 91% de las personas habían mejorado las tomografías computarizadas con pocos efectos secundarios[cita requerida]. La limitación de este estudio fue que no fue aleatorizado, doble ciego y controlado con placebo.
El medicamento ha sido aprobado para su uso en ensayos clínicos de la enfermedad por coronavirus 2019 en China. En marzo de 2020, Italia aprobó el medicamento para uso experimental contra COVID-19 y comenzó a realizar ensayos en las tres regiones más afectadas por la enfermedad. La Agencia Farmacéutica Italiana, sin embargo, ha recordado al público que la evidencia existente en apoyo de este medicamento es escasa y preliminar. Hay planes para estudiarlo en tres hospitales en Massachusetts, EE.UU. A partir del 20 de abril de 2020. A principios de mayo de 2020, se está iniciando un ensayo en Londres, Reino Unido.
El medicamento fue aprobado para el tratamiento de COVID-19 en los entornos hospitalarios de Rusia el 29 de mayo de 2020, luego de que un ensayo clínico aleatorizado abierto en curso había reclutado a 60 sujetos con favipiravir. Según el registro de ensayos clínicos del gobierno, se espera que este estudio COVID-FPR-01 reclute a 390 sujetos en general y finalice antes del 31 de diciembre de 2020. El 30 de mayo de 2020, el Ministerio de Salud de Rusia aprobó una versión genérica de favipiravir llamado Avifavir . El Fondo de Inversión Directa de Rusia (RDIF) respaldó el desarrollo de Avifavir y lo encontró altamente efectivo en la primera fase de los ensayos clínicos . El 25 de junio de 2020, el Ministerio de Salud de Rusia aprobó un medicamento más basado en favipiravir. Una prueba de 50 pacientes en Bangladés condujo a una tasa de recuperación del 96% de los casos graves después de 10 días frente al 52% para el control[cita requerida].
RDIF respaldó el desarrollo de Avifavir y lo encontró altamente eficaz en la primera fase de los ensayos clínicos.
Enlaces externos
- «Avifavir». Referencia de drogas rusas. Medum.ru.
- «Favipiravir». Portal de Información sobre Medicamentos. Biblioteca Nacional de Medicina de los Estados Unidos.
| Control de autoridades |
|
|---|
-
 Datos: Q16934561
Datos: Q16934561
-
 Multimedia: Favipiravir / Q16934561
Multimedia: Favipiravir / Q16934561