Morfolino
En biología molecular un Morfolino o "Morpholino" es una molécula con unas determinadas características estructurales, que se usa para modificar la expresión genética. Los oligómeros de Morfolino (óligos) son una tecnología antisentido usada para bloquear el acceso de otras moléculas a secuencias específicas de un ácido nucleico. Los morfolinos bloquean pequeñas regiones (~25 bases) en la superficie donde tiene lugar el emparejamiento de bases de un ARN.
Este artículo se centra sólo en los óligos antisentido de Morfolino, que son análogos de ácidos nucleicos. La palabra "morfolino" puede aparecer en otros términos químicos, refiriéndose a la substancias químicas que contienen un anillo de morfolino (molécula cíclica) de seis miembros. Para evitar la confusión con otras moléculas que contienen morfolinos, cuando se describen los óligos de "Morfolino" estos se escriben a menudo con mayúscula como un nombre comercial, aunque este uso no siempre es coherente en la literatura científica. Los Morfolinos se denominan a veces "PMO" (phosphorodiamidate morpholino oligo).
Los Morfolinos se usan generalmente como herramientas para la investigación en genética inversa para interferir en la expresión génica (knockdown) de un determinado gen. Esto se consigue impidiéndole a las células fabricar una proteína específica o modificando el splicing del pre-ARNm. Bloquear la expresión génica es un método muy potente para poder conocer cuál es la función de una determinada proteína; de manera similar, hacer que un exón epecífico sea eliminado en el splicing puede ayudar a determinar la función del residuo proteico codificado en ese exón. Estas moléculas se utilizaron también en estudios en varios organismos modelo, como el ratón, pescado cebra, el anfibio Xenopus, y el erizo de mar.
Los Morfolinos están también en desarrollo como fármacos terapéuticos dirigidos contra organismos patógenos cómo bacterias o virus y para el avance de pacientes con dolencias de origen genético. Estos óligos sintéticos fueron ideados por James Y. Summerton (Gene Tools, LLC) y desarrollados en colaboración con Dwight D. Weller (AVI BioPharma Inc.).
Estructura
Los Morfolinos son moléculas sintéticas que son el resultado de rediseñar la estructura de los ácidos nucleicos naturales. Generalmente tienen una longitud de 25 bases, se unen a secuencias complementarias del ARN por emparejamiento de bases estándar. Estructuralmente, la diferencia entre los Morfolinos y el ADN es que a pesar de que los Morfolinos tienen las bases estándar de los ácidos nucleicos, dichas bases están unidas a anillos de morfolino en lugar de los anillos de la desoxirribosa y enlazadas por grupos fosforodiamidato en vez de por fosfatos. Esto puede ser más fácil de visualizar haciendo referencia a la primera figura de esta página y comparando las estructuras de las dos cadenas mostradas, una de ARN y a otra de Morfolino. El reemplazo de los fosfatos aniónicos por los grupos fosforodiamidato no cargados elimina la ionización en el rango normal del pH fisiológico, por lo que los Morfolinos en los organismos o en las células son moléculas no cargadas. El esqueleto completo de un Morfolino está hecho de estas subunidades modificadas. Los Morfolinos se usan principalmente como oligos monocatenarios, aunque pueden usarse heterodúplex formados por una cadena de Morfolino y una cadena complementaria de ADN en combinación con reactivos catiónicos que facilitan a su paso al citosol.
Función
Los Morfolinos no degradan las moléculas de ARN con las que se unen, a diferencia de lo que hacen muchos tipos estructurales antisentido (por ejemplo, fosforotioatos, siRNA). En su lugar, los morfolinos actúan por "bloqueo estérico", uniéndose a una secuencia diana dentro de un ARN, inhibiendo moléculas que de otro modo podrían interactuar con el ARN. Los óligos Morfolino se utilizan con frecuencia para investigar la función de un transcrito específico de ARNm en un embrión. Los biólogos que estudian el desarrollo embrionario inyectan oligos Morfolino en huevos o embriones de peces cebra (Danio rerio), el sapo Xenopus, el erizo de mar, o en el pez Fundulus heteroclitus produciendo embriones morfantes (del inglés morphant, es decir, con la expresión de genes bloqueada por tratamiento con Morfolinos), o introducen Morfolinos por electroporación en células de embriones de pollos en sus fases tardías de desarrollo. Usando sistemas apropiados que faciliten su paso al citosol, los Morfolinos pueden funcionar en los cultivos celulares. Los Morfolinos están siendo desarrollados cómo productos farmacéuticos con el nombre de "NeuGenes" por AVI BioPharma Inc. Fueron utilizados en mamíferos como el ratón y algunos están siendo actualmente probados en ensayos clínicos para el tratamiento de la distrofia muscular de Duchenne en humanos.
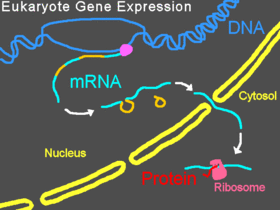
Expresión genética normal en eucariotas
En los eucariotas, el pre-ARNm se transcribe en el núcleo, se eliminan los intrones, y después el ARNm maduro se exporta al citoplasma. La subunidad menor del ribosoma normalmente se une a un extremo del ARNm y a él se unen varios factores de iniciación, formando el complejo de iniciación. El complejo de iniciación se desplaza sobre lo filamento de ARNm hasta que se coloca en el codón de iniciación, y después la subunidad mayor del ribosoma se junta con la menor y empieza la traducción de la proteína. A todo este proceso se le denomina expresión génica; es el proceso mediante el cual la información de un gen, codificada como una secuencia de bases del ADN, se convierte en la secuencia de aminoácidos de una proteína. Un Morfolino puede modificar el splicing o bloquear la traducción, dependiendo de la secuencia de bases del Morfolino.
Bloqueo de la traducción
Los Morfolinos unidos a la región 5'UTR de un ARN mensajero pueden interferir con la progresión con el complejo de iniciación ribosómico desde la caperuza 5' del ARNm al codón de iniciación. Esto impide la traducción de la región codificante del transcrito diana (lo que se llama "knocking down" de la expresión genética). Esto es muy útil experimentalmente cuando se desea conocer cuál es la función de una determinada proteína en la célula; los Morfolinos proporcionan un medio adecuado para realizar el knockdown de la expresión de la proteína y descubrir como este cambio afecta a la célula o al organismo. Algunos Morfolinos bloquean la expresión tan efectivamente que, después de la degradación de las proteínas preexistentes, las proteínas objetivo llegan a ser indetectables por la técnica del Western blot.
Modificación del splicing del ARNm
Los Morfolinos pueden interferir con el procesamento del pre-ARNm o bien impidiendo que los complejos de ribonucleoproteinas snRNP que dirigen el splicing se unan a sus dianas en los inicios de los intróns en un filamento de pre-ARNm, o bien bloqueando la adenina nucleofílica e impidiendo que se forme la estructura de empalme del splicing, o bien interfiriendo con la unión de las proteínas regulatorias del empalme como los silenciadores del empalme y los potenciadores del empalme.. Impedir durante el splicing la unión de la snRNP U1 (en el sitio donante) o U2/U5 (en el residuo de polipirimidina y sitio aceptor) puede modificar el splicing, normalmente excluyendo exones del ARNm maduro. Tomando cómo dianas algunos lugares de empalme puede originar la inclusión de un intrón en el ARNm maduro, mientras que la activación de sitios ocultos de empalme puede originar inclusiones o exclusiones parciales. Los sitios de unión de las snRNP U11/U12 pueden ser bloqueados también. La modificación puede ser convenientemente comprobada por reacción en cadena de la polimerase con transcritase inversa (RT-PCR) y se ponen en evidencia como un cambio de banda después de hacer una electroforesis en gel de productos de la RT-PCR.
Bloqueo de otros sitios del ARNm
Los Morfolinos se utilizaron también para bloquear la actividad de microARN y su maduración. Pueden también bloquear la actividad de ribozimas. Las funciones de las snRNP U2 y U12 pueden ser inhibidas con Morfolinos. Los Morfolinos dirigidos contra secuencias de ARNm ""resbaladizas" ("slippery" en inglés) en regiones codificantes de proteínas pueden inducir cambios en la pauta de lectura durante la traducción. Las actividades de los Morfolinos contra toda esta variedad de objetivos sugiere que los Morfolinos pueden utilizarse como una herramienta de uso general para bloquear la interacción de proteínas o ácidos nucleicos con ARNm.
Especificidades, estabilidad y efectos no antisentido
Los Morfolinos se convirtieron en una herramienta estándar de bloqueo genético en sistemas embrionarios de animales, los cuales presentan un grado de expresión genética más amplio que los tejidos adultos y pueden verse muy afectados por interacciones "fuera del objetivo". Después de las inyecciones iniciales en embriones de rana o pescados en la fase de una sola célula o de pocas células, los efectos de los Morpholinos pueden medirse hasta cinco días más tarde, después de que pasaron la mayoría de los procesos de organogénesis y diferenciación celular, observándose fenotipos coherentes con el bloqueo del gen objetivo. Óligos de control con secuencias irrelevantes normalmente no producen cambios en el fenotipo del embrión, lo que es una prueba de la especificidad de la secuencia de los óligos Morfolinos y de la falta de efectos no antisentido. La dosis requerida para el bloqueo (knockdown) puede ser reducida por la inyección simultánea de varios óligos Morfolino dirigidos contra el mismo ARNm, lo cual es una estrategia efectiva para reducir o eliminar las interacciones con ARN fuera del objetivo dependientes de la dosis.
Experimentos de rescate de ARNm pueden a menudo restaurar el fenotipo salvaje de los embriones y proporcionar pruebas de la especificidade de un Morfolino. En un rescate de ARNm, se inyectan simultáneamente un Morfolino y un ARNm que codifica la misma proteína que el Morfolino debe bloquear. Sin embargo, el ARNm de rescate tiene una región 5'-UTR modificada para que el ARNm de rescate no contenga dianas para el Morfolino, pero la región codificante del ARNm de rescate sí codifica la proteína que interesa. La traducción del ARNm de rescate sustituye la producción de la proteína que había sido bloqueada por el Morfolino. Como el ARNm de rescate no afecta a los cambios fenotípicos debidos a la modulación de la expresión génica fuera del objetivo hecha por los Morfolinos, esta vuelta al fenotipo salvaje es una evidencia adicional de la especificidade de los Morfolinos.
Debido a tener esqueletos moleculares completamente artificiales, los Morfolinos no son reconocidos por las proteínas celulares. Las nucleasas no degradan Morfolinos, ni tampoco son degradados en el suero o en las células. Los Morfolinos no activan receptores de tipo Toll, por lo que no activan respuestas inmunitarias como la inducción del interferón o la respuesta inflamatoria mediada por NF-κB. Los Morfolinos no modifican la metilación del ADN.
Un motivo de preocupación en el uso de Morfolinos es su potencial de producir efectos "fuera del objetivo". Hasta el 18% de los Morfolinos parecen producir fenotipos fuera del objetivo, incluyendo la muerte celular en el sistema nervioso central y tejidos de las somitas de los embriones del pez cebra. La mayoría de estos efectos parece que si deben a la activación de la apoptosis mediada por p53, y pueden ser suprimidos por la inyección simultánea de un Morfolino anti-p53 y del Morfolino experimental. Parece que estos efectos son específicos de secuencia; ya que en muchos casos, si un Morfolino se asocia con efectos fuera del objetivo, un Morfolino con una secuencia de 4 bases no complementaria no desencadena estos efectos. La cuestión de si un fenotipo morfante observado se debe al pretendido bloqueo genético o a una interacción fuera de la diana puede ser con frecuencia dilucidada llevando a cabo otro experimento para confirmar que el fenotipo morfante observado es un resultado del bloqueo de la diana pretendida. Esto puede hacerse recapitulando el fenotipo morfante con un segundo Morfolino que no se solape en secuencia dirigido contra el mismo ARNm o confirmando los fenotipos observados usando un mutante o con métodos dominante-negativo. Como se mencionó antes, el rescate de fenotipos observados inyectando simultáneamente un ARNm de rescate es, cuando es factible hacerlo, una prueba fiable de la especificidad de un Morfolino.
Entrada en la célula
Para que un Morfolino sea efectivo debe penetrar en la célula atravesando la membrana celular. Una vez que están en el citosol, los Morfolinos difunden libremente entre el citosol y el núcleo, como se demuestra por la actividad de la modificación del splicing exhibida por los Morfolinos observada después de la microinyección en el citosol de las células. Se usan diferentes métodos para introducirlos en embriones, células cultivadas o en animales adultos. Para su introducción en embrións se usa un aparato de microinyección, y las inyecciones se realizan normalmente en la fase embrionaria de una célula o de pocas células; un método alternativo para su introducción en embriones es la electroporación (descargas eléctricas que crean poros en la membrana), que puede facilitar la entrada de los óligos en los tejidos de fases embrionarias posteriores. Técnicas comunes para la introducción en células cultivadas son el uso del péptido Endo-Porter (que hace que el Morfolino sea liberado de los endosomas), el "Sistema Especial" de introducción (que usa un heterodúplex Morfolino-ADN y un agente de penetración polietilenimina etoxilado), la electroporación, o el scrape loading (carga por raspado).
La introducción en tejidos adultos normalmente es difícil, aunque hay algunos sistemas que permiten la absorción de óligos Morfolino no modificados (entre los que se incluyen las células musculares, ya de por sí muy permeables, características de la distrofia muscular de Duchenne o las células del endotelio vascular estresadas durante una anxioplastia). Aunque son permeables a los líquidos intercelulares, los PMOs (Morfolinos) no conjugados se distribuyen de forma bastante limitada en el citosol y núcleo en los tejidos sanos cuando son administrados por vía IV. La administración sistémica en muchas células en los organismos adultos puede realizarse usando conjugados covalentes de los óligos Morfolino, que llevan péptidos de penetración celular unidos, y, aunque fue asociada la toxicidad con el uso de dosis moderadas de conjugados de péptidos, fueron utilizados con efectividad in vivo para la introducción de óligos en dosis inferiores a las que causan toxicidad. Un dendrímero octa-guanidino unido al extremo de un Morfolino puede hacer penetrar el óligo modificado (llamado Vivo-Morfolino) desde la sangre al citosol celular. Los Morfolinos con capacidad de penetración, como los conjugados con péptidos o los Vivo-Morfolinos, son muy prometedores para usos terapéuticos en dolencias virales y genéticas.
Véase también
Bibliografía
- «Varios artigos». Genesis : The Journal of Genetics and Development (en inglés) 30 (3 (special issue)): 89-200. xullo 2001. ISSN 1526-954X. doi:10.1002/gene.v30:3.
- Moulton Jon (2007). John Wiley & Sons, Inc. - New Jersey, ed. Current Protocols in Nucleic Acid Chemistry. Using Morpholinos to Control Gene Expression (Unit 4.30). Beaucage Serge. ISBN 978-0-471-24662-6.
Otros artículos
| Control de autoridades |
|
|---|
-
 Datos: Q424607
Datos: Q424607
-
 Multimedia: Morpholinos / Q424607
Multimedia: Morpholinos / Q424607