
Inmunofluorescencia

La inmunofluorescencia es una técnica de inmunomarcación que hace uso de anticuerpos unidos químicamente a una sustancia fluorescente para demostrar la presencia de una determinada molécula. Es una técnica que tiene variantes cuantitativas (por ejemplo FPIA) y cualitativas (la inmunotinción de células para su observación por microscopía fluorescente).
Generalidades
La inmunofluorescencia, como todos los inmunoensayos, aprovecha la capacidad que tienen los anticuerpos para unirse con alta especificidad a una determinada molécula blanco; pero se diferencia de otras técnicas inmunohistoquímicas en que aquí la marca unida al anticuerpo es una molécula fluorescente tal como por ejemplo, el isotiocianato de fluoresceína. El anticuerpo marcado se hace reaccionar contra un preparado biológico y luego se expone la muestra así tratada a una fuente de luz de onda corta (ultravioleta o azul) seleccionada por medio de un monocromador. Esta luz de onda corta genera un fenómeno de fluorescencia en la molécula marcadora que a su vez emite luz a una longitud de onda más larga (verde, amarillo o naranja). Esta luz emitida puede ser cuantificada con facilidad por fotometría o en el caso de tratarse de preparados histológicos, puede ser observada por medio de un microscopio de fluorescencia. En el caso de la utilización de la inmunofluorescencia como método de tinción para microscopía óptica, el fluorescente revela la localización a nivel celular o subcelular de la molécula diana.
La inmunofluorescencia, como técnica de tinción, puede ser utilizada en cortes de tejidos, líneas celulares cultivadas, células individuales y secreciones que contengan células en suspensión (por ejemplo esputo) con la finalidad de analizar la presencia y distribución de proteínas, glúcidos y moléculas pequeñas tanto de origen biológico como no. Esta técnica puede ser utilizada en combinación con otras técnicas de coloración fluorescente que no hagan uso de anticuerpos, como por ejemplo DAPI para marcar ADN.
Existen varios diseños de microscopios que pueden ser utilizados para el análisis de preparados histológicos marcados por inmunofluorescencia. El más simple de todos es el microscopio de epifluorescencia, aunque también es ampliamente utilizado el microscopio confocal. También es posible utilizar varios tipos de técnicas microscópicas de alta resolución.
La inmunofluorescencia como técnica inmunoquímica de cuantificación se puede utilizar tanto en muestras de origen biológico como en muestras no biológicas, siempre que se encuentren en un medio favorable para la unión de los anticuerpos. En general se utiliza una solución PBS (Buffer fosfato salino) como medio de reacción. Un ejemplo de este tipo de técnicas es la FPIA.
Tipos de inmunofluorescencia

Existen dos tipos de técnicas de inmunofluorescencia; primaria (o directa) y secundaria (o indirecta).
Primaria o IFD
La inmunofluorescencia primaria, o directa, también conocida por sus siglas IFD (inmunofluorescencia directa), hace uso de un único anticuerpo que se encuentra químicamente unido a un fluorocromo. El anticuerpo reconoce la molécula diana y se une a ella directamente. En el caso de utilizarse como técnica de tinción inmunohistoquímica la región donde se deposita la molécula diana puede ser identificada al microscopio de fluorescencia como una zona brillante.
Secundaria o IFI
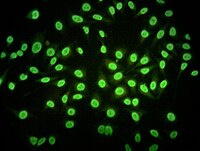
La inmunofluorescencia secundaria, o indirecta (también conocida por sus siglas IFI) hace uso de dos anticuerpos; el anticuerpo primario es el que reconoce y se une a la molécula diana, mientras que el secundario que es el que se encuentra marcado con el fluoróforo, reconoce al primario y se une a él. Esta técnica es un poco más compleja que la IFD, requiere más pasos y es más posible que sufra interferencias, pero en contrapartida es mucho más flexible que una técnica directa y debido a que es posible que un anticuerpo primario una a más de un anticuerpo secundario, implica un efecto de amplificación que también aumenta la sensibilidad de la técnica.
Esta técnica es posible, debido a que los anticuerpos constan de dos partes, una región variable (que es la que reconoce al antígeno) y una región constante (que es la reconocida por el anticuerpo secundario)
Es posible que existan varios anticuerpos que reconozcan diferentes antígenos (es decir que tengan diferentes regiones variables) pero que compartan la misma región constante. Todos estos anticuerpos con diferentes especificidades pueden ser reconocidos a su vez por un único anticuerpo secundario que reconozca la región constante. Esto ahorra el esfuerzo técnico y el costo de modificar cada uno de los anticuerpos primarios para acarrear el fluoróforo.
Típicamente se hace uso de diferentes anticuerpos primarios con diferentes regiones constantes generados por la estimulación en la producción de anticuerpos en diferentes especies. Por ejemplo, un investigador puede estimular la producción de un determinado anticuerpo primario en una cabra, y luego emplear un anticuerpo de conejo que reconozca la región constante de los anticuerpos de cabra (anticuerpos de "conejo anti-cabra"). Y luego puede crear un segundo juego de anticuerpos en ratón que sean reconocidos por un tipo diferente de anticuerpos "burro anti-ratón". Esto permite reutilizar los anticuerpos marcados, que son muy difíciles de obtener, en múltiples experimentos.
Limitaciones
Al igual que la mayoría de las técnicas de fluorescencia, un problema muy significativo con la inmunofluorescencia es el fotoblanqueo. Es decir la pérdida de la actividad fluorescente causada por la exposición a la luz. Esta pérdida de actividad puede ser controlada reduciendo la intensidad o el tiempo de exposición a la luz, incrementando la concentración de fluoróforo, o empleando fluoróforos más robustos que sean menos propensos al fotoblanqueo. Por ejemplo, Alexa Fluor, Seta Fluors, o DyLight Fluor.
Las técnicas de tinción por inmunofluorescencia para la marcación de estructuras subcelulares se encuentra limitada a su uso en células fijadas (muertas) ya que los anticuerpos no son capaces de atravesar las membranas íntegras de las células vivas. Sin embargo si es posible detectar proteínas o moléculas en suspensión en el sobrenadante, en la periferia (membrana) y proximidades de una célula viva, esto posibilita marcar células vivas siempre que no se requiera ver su estructura interna.
En el caso de células fijadas, dependiendo de la técnica de fijado utilizada, puede ocurrir que las proteínas de interés queden unidas por enlaces cruzados a otras proteínas, lo que puede causar tanto falsos positivos, como falsos negativos debidos a unión inespecífica.
Una técnica alternativa es aprovechar la síntesis de proteínas recombinantes que contengan dominios fluorescentes, por ejemplo dominios de la proteína verde fluorescente (GFP). Estas proteínas recombinantes funcionan como una marca interna que permite seguir todo el proceso de síntesis y localización de la proteína original en una célula viva.
Esta última opción, aunque puede parecer una alternativa muy elegante a la inmunofluorescencia, requiere que las células sean transfectadas con el gen de la GFP, y esto además de las grandes complicaciones técnicas, requiere que las células (u organismos) recombinantes obtenidos sean mantenidos en condiciones muy estrictas de seguridad biológica.
Bibliografía
- Burtis CA, Ashwood ER, Burns DE, Sawyer BG.(2008). «Tietz Fundamentals of Clinical Chemistry» Saunders (Elsevier) 6º ed. ISBN 978-0-7216-3865-2.
Enlaces externos
- Images associated with autoimmune diseases sitio de la Universidad de Birmingham
- Immunofluorescence protocol and confocal microscopy resources at confocal-microscopy.org
- Immunofluorescence Staining Protocol Archivado el 21 de agosto de 2008 en Wayback Machine.
- Overview at Davidson College
- MeSH: Immunofluorescence (en inglés)
- Example IFA protocol (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). on OpenWetWare
- SynD - Automatic synapse and neurite detection in immuno-fluorescence images
| Control de autoridades |
|
|---|
-
 Datos: Q592324
Datos: Q592324
-
 Multimedia: Immunofluorescence microscopy / Q592324
Multimedia: Immunofluorescence microscopy / Q592324
