
Hidrazina
| Hidrazina | ||
|---|---|---|
| ||

| ||
| Nombre IUPAC | ||
| Hidrazina | ||
| General | ||
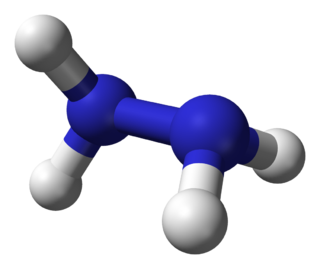
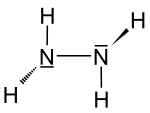
| Fórmula semidesarrollada | NH2-NH2 | |
| Fórmula estructural |
|
|
| Fórmula molecular | N2H4 | |
| Identificadores | ||
| Número CAS | 302-01-2 | |
| Número RTECS | MU7175000 | |
| ChEBI | 15571 | |
| ChEMBL | CHEMBL1237174 | |
| ChemSpider | 8960 | |
| PubChem | 9321 | |
| UNII | 27RFH0GB4R | |
| KEGG | C05361 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1010 kg/m³; 1,01 g/cm³ | |
| Masa molar | 32,0 g/mol | |
| Punto de fusión | 274 K (1 °C) | |
| Punto de ebullición | 387 K (114 °C) | |
| Propiedades químicas | ||
| Acidez | 8,1±0,01 pKa | |
| Solubilidad en agua | Muy soluble | |
| Termoquímica | ||
| ΔfH0gas | 95,35 kJ/mol | |
| ΔfH0líquido | 50,63 kJ/mol | |
| ΔfH0sólido | 37,63 kJ/mol | |
| S0gas, 1 bar | 238,66 J·mol–1·K | |
| S0líquido, 1 bar | 121,52 J·mol–1·K–1 | |
| Peligrosidad | ||
| NFPA 704 |
3
3
3
|
|
| Riesgos | ||
| Ingestión | Tóxico, posiblemente un agente cancerígeno. | |
| Inhalación | Muy peligroso, extremadamente destructivo para el tracto respiratorio. | |
| Piel | Puede causar quemaduras severas, puede ser absorbido por la sangre. | |
| Ojos | Puede causar daños permanentes. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La hidrazina o hidracina es un compuesto químico cuya fórmula química condensada es N2H4.
Se trata de un líquido incoloro y oleoso, con un olor similar al del amoníaco y que libera vapores cuando está expuesto al aire. Quema con llama apenas visible. Comercialmente se suministra en disolución acuosa o como hidrato de hidrazina (H2N−NH2 · H2O).
Se utiliza principalmente como espumante para la preparación de espumas poliméricas así como precursor de catalizadores de polimerización y fármacos. Adicionalmente se emplea como combustible para aviones, misiles, cohetes espaciales y satélites. El comburente utilizado en estos casos, habitualmente es el tetrahidruro de dinitrógeno. También se conoce como hidrazinas a los compuestos derivados de esta.
Por norma general la hidrazina no se utiliza como combustible, sino en cambio alguno de sus derivados como la metilhidrazina o la dimetilhidrazina asimétrica. El empleo de estas últimas comporta importantes ventajas, tales como ser almacenables a temperatura ambiente y entrar en combustión en cuanto se ponen en contacto con el comburente (a este tipo de combustibles se les llama hipergólicos). Sin embargo, debido a su alta toxicidad, se ha tendido a abandonar su uso.
Es importante mencionar que este compuesto químico reacciona con el oxígeno de la siguiente manera: N2H4 + O2 → N2 + 2 H2O, reduciendo la posibilidad de corrosión por oxidación en los metales. Además al entrar en contacto con el óxido férrico, genera magnetita, agua y nitrógeno: N2H4 + 6 Fe2O3 → 4 Fe3O4 + 2 H2O + N2.
Theodor Curtius sintetizó por primera vez hidrazina libre en 1889 a través de un tortuoso proceso.
Estructura molecular y propiedades
La hidrazina forma un monohidrato que es más denso (1,032 g / cm³) que el material anhidro.
La hidrazina puede surgir a través del enlace de un par moléculas de amoniaco por medio de la eliminación de una molécula de hidrógeno. Cada subunidad H 2 N-N tiene forma piramidal. La distancia NN es 1,45 Å (145 pm), y la molécula adopta una conformación gauche. La barrera de rotación es el doble que la de etano. Estas propiedades estructurales son similares a los del peróxido de hidrógeno gaseoso, que adopta una conformación anticlinal "oblicua", y también posee una elevada barrera de rotación.
La hidrazina tiene propiedades químicas básicas (alcalina) similares a las del amoniaco:
- N2H4 + H2O → [N2H5]+ + OH−
con los valores:
- Kb = 1.3 x 10−6
- pKa = 8.1
(Para el amoníaco Kb = 1.78 x 10−5) La hidracina es difícil diprotonate:
- [N2H5]+ + H2O → [N2H6]2+ + OH−Kb = 8.4 x 10−16
El calor de combustión de hidrazina en oxígeno (aire) es 194,1 x 105 J / kg.
Síntesis y fabricación
La hidrazina se produce por medio del proceso de Olin Raschig en el cual se hace reaccionar hipoclorito de sodio (el ingrediente activo en muchos blanqueadores) con amoniaco, este proceso fue dado a conocer en 1907. Este método se basa en la reacción de cloramina con amoníaco:
- NH2Cl + NH3 → H2N-NH2 + HCl
Otra ruta de síntesis de hidrazina implica la oxidación de urea con hipoclorito de sodio:
- (H2N)2C=O + NaOCl + 2 NaOH → N2H4 + H2O + NaCl + Na2CO3
La hidrazina puede ser sintetizada a partir de amoníaco y peróxido de hidrógeno en el proceso de Pechiney-Ugine-Kuhlmann, de acuerdo con la siguiente fórmula:
- 2NH3 + H2O2 → H2N-NH2 + 2H2O
En el ciclo de Atofina-PCUK, la hidrazina se produce en varias etapas a partir de acetona, amoníaco y peróxido de hidrógeno. Acetona y amoníaco reaccionan para dar primero la imina seguido de oxidación con peróxido de hidrógeno a la oxaziridina, un anillo de tres miembros que contiene carbono, oxígeno y nitrógeno, seguido por amonolisis a la hidrazona, un proceso que acopla dos átomos de nitrógeno. Esta hidrazona equivalente reacciona con una molécula más de acetona, y la resultante azina acetona se hidroliza para dar hidrazina, regenerando la acetona. A diferencia del procedimiento de Raschig, este proceso no produce sal. El PCUK significa Produits Chimiques Ugine Kuhlmann, un fabricante de productos químicos francés.
La hidrazina también se puede producir a través de los denominados procesos de la ketazina y peróxido.
Peligros
La hidrazina es altamente tóxica y peligrosamente inestable, especialmente en la forma anhidra. De acuerdo con la Agencia de Protección Ambiental de los EE. UU.:
Los síntomas agudos (a corto plazo), de la exposición a altos niveles de hidrazina pueden incluir irritación de los ojos, nariz y garganta, mareos, dolor de cabeza, náuseas, edema pulmonar, convulsiones, coma en los seres humanos. La exposición aguda también puede dañar el hígado, riñones y el sistema nervioso central. El líquido es corrosivo y puede producir dermatitis de contacto de la piel en seres humanos y animales. Se han observado efectos en pulmones, hígado, bazo y tiroides en animales expuestos crónicamente a la hidrazina por inhalación. Asimismo, existe correlación entre la exposición a hidracina y un aumento en la incidencia de cáncer de pulmón, de cavidad nasal y tumores hepáticos.
Las pruebas de límite de hidrazina en productos farmacéuticos sugieren que debería estar en el rango de ppm. La hidrazina también puede causar esteatosis. Al menos se conoce un humano que murió, después de 6 meses de exposición subletal de hidrato de hidrazina.
El 21 de febrero de 2008 los Estados Unidos de América destruyeron un satélite espía, también estadounidense, que estaba fuera de control, alegando que su depósito de combustible estaba lleno de hidrazina y que esta podría extenderse sobre algún área poblada.
El 29 de febrero de 2008 se produjo un accidente de dos camiones que transportaban hidrazina, en San Carlos de Bariloche, una ciudad de Argentina que pertenece a la provincia de Río Negro, y es la cabecera del Departamento de Bariloche. No hubo ningún herido, aunque uno de los conductores presentaba mareos por la inhalación de esa sustancia.
Véase también
Enlaces externos
- ATSDR en español - ToxFAQs™: hidrazinas
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química de la hidrazina.
- Monometilhidrazina en la Encyclopedia Astronautica (en inglés)
- Dimetilhidrazina asimétrica en la Encyclopedia Astronautica (en inglés)
| Control de autoridades |
|
|---|
