Hexametilentetramina
| Hexametilentetramina | ||
|---|---|---|
| ||

| ||
| Nombre IUPAC | ||
| 1,3,5,7-tetraazatriciclo[3.3.1.13,7]decano | ||
| General | ||
| Otros nombres |
Hexamina Metenamina Urotropina 1,3,5,7-Tetraazaadamantano Urodeína Formamina Hexaformo HMTA |
|
| Fórmula molecular | C6H12N4 | |
| Identificadores | ||
| Número CAS | 100-97-0 | |
| Número RTECS | MN4725000 | |
| ChEMBL | CHEMBL1201270 | |
| ChemSpider | 3959 | |
| DrugBank | 06799 | |
| PubChem | 4101 | |
| UNII | J50OIX95QV | |
| KEGG | D00393 | |
|
C1N2CN3CN1CN(C2)C3
| ||
| Propiedades físicas | ||
| Apariencia | Sólido. Cristales o polvo blanco. | |
| Olor | Inodoro | |
| Densidad | 1331 kg/m³; 1,331 g/cm³ | |
| Masa molar | 140,19 g/mol | |
| Punto de ebullición | 280 °C (553 K) | |
| Presión de vapor | 4 × 10−3mmHg | |
| Índice de refracción (nD) | 1,731 | |
| Propiedades químicas | ||
| Acidez | 5,1 pKa | |
| Solubilidad en agua | 895 g/L (20 °C) | |
| Solubilidad | 80 g/L (en etanol) | |
| log P | -2,84 | |
| Familia | Amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 523,15 K (250 °C) | |
| Temperatura de autoignición | 553,15 K (280 °C) | |
| Compuestos relacionados | ||
| aminas y diaminas |
1-hexanamina Ciclohexanamina 1,6-hexanodiamina Tetrametiletilendiamina |
|
| tetraminas |
Trietilentetramina Tris(2-aminoetil)amina |
|
| aminas heterocíclicas |
Piperidina Piperazina |
|
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
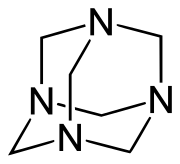
La hexametilentetramina es un compuesto orgánico heterocíclico cuya fórmula es (CH2)6N4. También es conocida como hexamina, metenamina, urotropina, formamina, HMTA y hexaformo.
Posee una estructura de jaula simétrica tetraédrica. Es similar a la del adamantano, cuyos cuatro «vértices» son átomos de nitrógeno y las «aristas» son grupos metileno. Si bien la forma molecular define una jaula, no existe espacio libre en su interior para alojar otros átomos o moléculas.
Este compuesto fue descubierto por el químico ruso Aleksandr Butlerov en 1859.
Propiedades físicas y químicas
A temperatura ambiente, la hexametilentetramina es un sólido con una densidad de 1,331 g/L. Su aspecto es el de polvo o cristales de color blanco prácticamente inodoros; los cristales formados en alcohol son rómbicos. Sublima cuando se calienta a 280 °C, siendo su vapor 4,9 veces más denso que el aire. Es muy soluble en agua —en torno a 895 g/L— y también soluble en etanol y acetona. El valor del logaritmo de su coeficiente de reparto, logP = -2,84, indica que su solubilidad es notablemente mayor en disolventes polares que en apolares; así, es sólo ligeramente soluble en éter etílico y prácticamente insoluble en éter de petróleo.
La hexametilentetramina es una sustancia higroscópica. El valor de su pKa es igual a 5,13 y se descompone cuando es tratada con ácidos fuertes o ácidos orgánicos concentrados. Es también incompatible con oxidantes fuertes, reaccionando violentamente con peróxido de sodio. A más de 90 °C reacciona de forma explosiva con el 1-bromopentaborano(9). Es, además, corrosiva para algunos metales como aluminio y zinc.
Síntesis
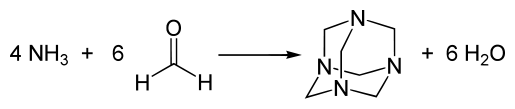
La hexametilentetramina se prepara haciendo reaccionar formaldehído y amoníaco, reacción que puede tener lugar en fase gaseosa y en disolución:
Otra vía para sintetizar esta poliamina es por N-desnitración de una nitroamina —como octógeno (HMX)— por una dihidronicotinamida. Relacionada con la anterior síntesis es la reducción controlada de ciclotrimetilentrinitramina (RDX), sustancia extremadamente explosiva, que también produce hexametilentetramina.
Usos
Usos históricos
En medicina, la hexametilentetramina se usó por primera vez en 1899 como antiséptico urinario. Solo se empleó en casos de orina ácida, siendo utilizado el ácido bórico en el caso de infecciones de tracto urinario con orina alcalina. Se observó que la eficacia de esta tetramina dependía enormemente de la acidez de la orina, más que de la cantidad de medicamento administrado; de hecho, en condiciones alcalinas, la hexametilentetramina es casi completamente inactiva.
Durante la Primera Guerra Mundial, la hexametilentetramina también se empleó para tratar a soldados expuestos a fosgeno. Estudios posteriores han demostrado que dosis elevadas de hexametilentetramina proporcionan cierta protección si se toma antes de la exposición, pero ninguna si se administra a posteriori.
Usos industriales
El principal uso de la hexametilentetramina radica en la producción de preparaciones —en polvo o líquidas— de resinas fenólicas, donde se añade como componente para dar resistencia. Estos productos se usan como ligantes, por ejemplo en revestimientos de frenos y embragues, en productos abrasivos, en ciertos tejidos y en materiales ignífugos.
Junto al 1,3,5-trioxano, la hexametilentetramina es un componente de pastillas de combustible usadas por campistas u organizaciones militares para calentar comida. Al arder no desprende humo y tampoco deja cenizas residuales, además de tener una alta densidad energética (30,0 MJ/kg).
Esta poliamina también ha sido empleada como conservante en la industria alimentaria (como INS 239). Está autorizado su uso en la Unión Europea con la denominación E239 E, si bien no lo está en países como Estados Unidos, Rusia, Australia o Nueva Zelanda.
Por otra parte, la hexametilentetramina es un reactivo versátil en la síntesis orgánica. Se emplea en la reacción de Duff (formilación de anillos aromáticos activados), en la reacción de Sommelet (conversión de haluros bencénicos en aldehídos) y en la reacción de Delepine (síntesis de aminas a partir de haluros de alquilo).
Asimismo, es un componente básico en la producción de explosivos como RDX, C-4, octógeno, dinitrato de hexamina y HMTD.
Usos en medicina
La hexametilentetramina se usa como sal del ácido mandélico —mandelato de metenamina— para tratar infecciones del tracto urinario. La hexametilentetramina se descompone a pH 5,5 o inferior, formándose amoníaco y formaldehído, teniendo este último actividad bactericida. La acidez de la orina se asegura administrando vitamina C (ácido ascórbico) o cloruro de amonio. Aunque su utilización como medicamento se había reducido a finales de los años 1990 debido a efectos adversos —cistitis hemorrágica por sobredosis—, su uso se ha aprobado nuevamente por el aumento de la resistencia a los antibióticos habitualmente empleados. Este fármaco está particularmente indicado para el tratamiento profiláctico a largo plazo de la infección del tracto urinario, dado que las bacterias no desarrollan resistencia al formaldehído. En un estudio de no inferioridad, randomizado, multicéntrico y sin ciego publicado en marzo del 2022 en la revista The BMJ se observó que la hexametilentetramina resultó no inferior en relación con el uso de terapia antimicrobiana en relación con la prevención de infecciones urinarias
Véase también
Los compuestos siguientes poseen la estructura del adamantano con uno, dos o tres átomos de nitrógeno:
- 1-azatriciclo[3.3.1.13,7]decano
- 1,3-diazadamantano
- 1,3,5-triazadamantano
Las siguientes aminas derivan de hidrocarburos bicíclicos:
| Control de autoridades |
|
|---|