
Carbazol
| Carbazol | ||
|---|---|---|

| ||
| Nombre IUPAC | ||
| 9H-carbazol, 9-azafluoreno, dibenzopirrol, difenilenimina, difenilenimida | ||
| General | ||
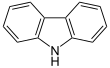
| Fórmula estructural |
|
|
| Fórmula molecular | C12H9N | |
| Identificadores | ||
| Número CAS | 86-74-8 | |
| ChEBI | 27543 | |
| ChEMBL | CHEMBL243580 | |
| ChemSpider | 6593 | |
| DrugBank | 07301 | |
| PubChem | 6854 | |
| UNII | 0P2197HHHN | |
| KEGG | C08060 | |
| Propiedades físicas | ||
| Apariencia | Escamas monoclínicas | |
| Densidad | 1,301 kg/m³; 0,001301 g/cm³ | |
| Masa molar | 167.206 g/mol | |
| Punto de fusión | 246,3 °C (519 K) | |
| Punto de ebullición | 354,69 °C (628 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El carbazol es un compuesto aromático heterocíclico. Es un triciclo que consiste en un anillo de pirrol con dos anillos de benceno fusionados en los enlaces b y d. Se puede considerar también como un anillo de indol con un átomo de benceno fusionado en el enlace b. Otra descripción establece que el carbazol es un 9-azafluoreno.
Propiedades
Cristaliza con etanol, benceno, tolueno y ácido acético glacial. Exhibe una fuerte fluorescencia y larga fosforescencia por exposición con luz ultravioleta. Es una base muy débil. Insoluble en agua. Un gramo se disuelve en 3 mL de quinolina, 6 mL de piridina, 9 mL de acetona a 50º, 35 mL de éter, 120 mL de benceno y 135 mL de etanol absoluto. Se disuelve ligeramente en éter de petróleo, disolventes organoclorados y ácido acético. Se disuelve en ácido sulfúrico sin descomposición. La dosis letal oral en ratas es LD50>5g/kg.
Síntesis
Reacción de Pschorr
La reacción de Pschorr es una variante intramolecular de la Reacción de Gomberg-Bachmann, en donde ambos anillos se encuentran vinculados por un grupo bivalente. Para carbazoles, Z = NH (Puente imino):
La Ciclización de Borsche-Drechsel es un método clásico de síntesis de 1,2,3,4 tetrahidrocarbazoles.
Otro método para la síntesis de carbazoles es la Reacción de Graebe–Ullmann.
Un tercer método para obtener carbazoles es la síntesis de Cadogan.
También se puede utilizar el método de Bucherer:
Iwaki y colaboradores reportaron un método para sintetizar carbazoles y β-carbolinas:
Se pueden utilizar métodos de síntesis de indoles para construir carbazoles.
Reacciones
Es una base débil. Se comporta químicamente como una N, N-difenilamina. Los derivados de monosustitución electrofílica aromática se llevan a cabo en la posición 3.
Usos
Es intermediario en la producción de varios pigmentos como el Pigmento violeta 23. Se utiliza en la fabricación de placas fotográficas sensibles a la luz ultravioleta. También se utiliza como reactivo para la lignina, carbohidratos y formaldehído.
Carbazoles naturales
En 1872 Graebe y Glaser fueron los primeros en describir el compuesto padre 9H-carbazol que se obtuvo de la fracción antracénica del destilado de alquitrán de hulla. Noventa años más tarde, la divulgación de las propiedades antimicrobianas de la murrayanina (3-formil-1-metoxicarbazol), aislado de la planta Murraya koenigii despertó un fuerte interés de los químicos y biólogos. Los carbazoles tienen dos precursores biosintéticos principales derivados del ácido antranílico: la 4-hidroxi-2-quinolona y el triptófano.
Los alcaloides carbazólicos de plantas tienen como precursor al 3-metilcarbazol, el cual procede de la prenilación de la 4-hidroxiquinolona.
Estos alcaloides son indicadores quimiotaxonómicos de plantas pertenecientes a la familia Rutaceae (géneros: Murraya, Clausena, Glycosmis)
| Nombre | R1 | R2 | R3 |
| 3-Metilcarbazol | Me | H | H |
| 3-Formilcarbazol | CHO | H | H |
| Ácido 3-carbazolcarboxílico | COOH | H | H |
| 1-Hidroxi-3-metilcarbazol | Me | H | OH |
| O-Desmetilmurrayanina | CHO | H | OH |
| Clausina E | COOMe | H | OH |
| Murrayafolina A | Me | H | OMe |
| Koenoline | Me | H | OMe |
| Murrayanina | CHO | H | OMe |
| Ácido mukoénico | COOH | H | OMe |
| Mukonina | COOH | H | OMe |
| 2-Hidroxi-3-metilcarbazol | Me | OH | H |
| Mukonal | CHO | OH | H |
| Mukonidina | COOH | OH | H |
| 2-Metoxi-3-metilcarbazol | Me | OMe | H |
| Glicosinina | CHO | OMe | H |
| Clausina L | COOMe | OMe | H |
| Girinimbilol (Mukoenina A) | Me | OH | CH2CH=CMe2 |
| Heptafilina | Me | OH | CH2CH=CMe2 |
Anillos aromáticos relacionados
| Control de autoridades |
|
|---|







